تاریخچه عناصر شیمیایی

تاریخچه عناصر شیمیایی
در یونان قدیم و در سده پنجم بیش از میلاد ، عدهای از فیلسوفان آب را مادةالمواد پنداشته، گروهی هم آتش و عده ای هم هوا را منشاء همه اجسام در طبیعت میدانستند. در پایان سده پنجم پیش از میلاد ، "امپیدوکل" ، فرضیه پیشینیان خود را در یک فرضیه جمعآوری و به آن عنصر خاک را نیز اضافه کرد و فرضیه چهار عنصر شناخته گردید که هر کدام دارای یک خاصیت معین میباشند و این خواص قابل تبدیل به یکدیگرند.
"ارسطو"(384-322 پیش از میلاد) که نفوذ زیادی در سایر فلاسفه بعدی خود داشت،معتقد بود که تمام مواد از عناصری ساخته شدهاند که این عناصر ، ازلی وقدیماند، نه از عدم بوجود میآیند و نه معدوم میشوند و کمیت آنها درطبیعت تغییر ناپذیر است. به عقیده او ماده اولیه دارای چهار خاصیت است کهدو به دو در برابر هم و به صورت زوج متضاد قرار گرفتهاند. این چهار مادهعبارتند از: گرمی ، سردی ، خشکی و رطوبت. تفاوت مواد ، وابسته به مقدارترکیبی آن از هر یک از این چهار عنصر و نسبت آنها میباشد. ترکیب دو زوجخاصیت توسط ارسطو ، او را سرانجام با امپیدوکل در مکتب چهار عنصر همراه ساخت که خاک ، آب ، آتش و هوا باشد.
در قرون وسطی ، کیمیاگران روشی را برای تشخیص عناصر ساده از اجسام پیچیده نداشتند و تنها چند فلز را میشناختند، مانند آرسنیک ، قلع و غیره. کیمیاگران سدههای میانی ، شمار عناصر را برابر با 7 سیاره میدانستند: مس ، آهن ، نقره ، طلا ، قلع ، سرب ، گوگرد و جیوه. گوگرد را پدر عناصر و جیوه را مادر آنها میدانستند.
با پیشرفت دانش در سدههای اخیر ، کمکم ماهیت عناصر روشن گردید، مواد گوناگون در دست تجزیه و ترکیبقرار گرفت و عناصر شیمیایی ، ابتدا بطور مجزا و جدا از هم مورد مطالعهقرار گرفتند و سپس بعدها پیوند و بستگی کامل آنها در جدول پریود ( جدول مندلیف ) منعکس گردید. با پیشرفت علم ، نحوه پیوستگی این جدول نیز کاملتر و دقیقتر شد که در ذیل به شرح آنها میپردازیم.
اولین طبقه بندی عناصر شیمیایی
در 1829 ، شیمیدان آلمانی "دوبراینر" ، نتیجه مطالعات خود رادر طبقهبندی عناصر برحسب خواص شیمیایی مشابه آنها منتشر کرد و استنباطکرد که میتوان عناصری را که دارای خواص مشابه هستند، به دستههای سهتاییتقسیم کرد که در این صورت وزن اتمی یکی از آنها معدل وزنهای اتمی دو تای دیگر است. مثلا وزن اتمی لیتیم ، سدیم و پتاسیم ، بهترتیب 7 ، 23 و 39 است. از روی وزن اتمی لیتیم و پتاسیم میتوان وزن اتمی سدیم را به صورت زیر بدست آورد:
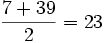
دوبراینر ، این گروهها را تریاد یا گروههای سه گانه نامید. لیکن در میان همه عناصری که در آن زمان شناخته شده بود، وی تنها به کشف چهار گروه سه گانه یا چهار تریاد موفق گردید.
مطالعات و بررسیهای انجام شده پیش از مندلیف
در سال 1862 ، "Dechancourtoi" ، عناصر را به ترتیب وزن اتمی، بوسیله نقاطی روی یک مارپیچ نمایش داد. بطوریکه اختلاف اوزان اتمی برایدو نقطه که فاصله یک حلقه روی مارپیچ داشتند، 16 بود و سعی کرد که تشابهخواص یک گروه را از روی ارتباط هندسی بین نقاط مارپیچ نمایش دهد. مثلا کلر ، برم و ید ، بوسیله نقاط واقع در یک خط نمایش داده شدند؛ ولی متاسفانه کارش مورد توجه واقع نگردید.
در سال 1863 ، "نیولندز"، دانشمند انگلیسی ، عناصر را به ترتیب افزایش وزن اتمی تنظیم کرد و بدیننکته پی برد که هر هشت عنصر از هر کجا که شروع میشود، مانند نت هشتم درموسیقی تقریبا خواص عنصر نخستین را تکرار میکند. این رابطه را قانون اکتاوها نامید. سه اکتاو نخستین نیولندز برای نشان دادن سیستم او در زیر آورده میشود:
|
این سیستم ، تناقضات زیادی را دربر داشت، لیکن بر پایه این فرضیه صحیحنهاده شده بود که خواص عناصر برحسب پریودی معین ، با افزایش وزن اتمیتغییر میکنند.
سال بعد ، "Lother- Mayer" جدول شامل بعضی عناصر شیمیایی که برحسب ظرفیت آنها به شش گروه تقسیم شده بود، منتشر کرد. Mayerبا توجه به اینکه اختلاف میان وزن اتمی عناصر متوالی در هر گروه ، پایداریمعینی را نشان میدهد، نوشته خود را بدین مضمون پایان داد: « شکی نیست کهمیان ارزش عددی و وزنهای اتمی رابطه معینی وجود دارد. » لیکن مایر نتیجههای قطعیتری درباره ماهیت و اهمیت این رابطه بدست نیاورد.
"مندلیف" (Dmitri Mandeleew)روی جدول تنظیمی خود 20 سال کار کرد تا توانست در سال 1868 آنرا عرضه کندو در مارس 1869 اولین گزارش مختصر خود راجع به قانون پریود به انجمن شیمی_ فیزیک پترزبورگ تقدیم داشت.
قانون تناوبی مندلیف
کشف مهم مندلیف که شاهکار تحقیقات علمی اوست، این بود کهمتوجه شد خواص قابل اندازه گیری عناصر با افزایش اوزان اتمی ترقی یا تنزلنمیکند، بلکه این تغییرات ، تناوب دارد و بطور متناوب گاهی صعودی و گاهینزولی است. مندلیف برای اینکه عناصر مشابه را زیر یکدیگر قراردهد، ناچار شد برای برخی عناصر کشف نشده در آن زمان ، در جدول خود جایخالی بگذارد و او توانست خواص سه عنصر ناشناخته را پیش بینی نماید.
با کشف گالیم در سال 1875 توسط "de.Bosibaudran" فرانسوی ، اسکاندیم توسط Larnilson سوئدی در سال 1879 و ژرمانیم توسط Clemenswinkler آلمانی در سال 1885 ، پیشگوییهای مندلیف تائید گردید و سیستم تناوبی ، جایگاهی مناسب یافت. مندلیفوجود گازهای نجیب (Ra , Xe , Kr , Ar , Ne , He ) را پیش بینی نکرد، امادر هر حال پس از کشف این عناصر در سالهای 1898-1892 ، عناصر مزبور بهسهولت در گروه خود در جدول جا داده شدند.
درست ماندن جدول تناوبیایجاب میکرد که سه عنصر I , Ni , K در محلی غیر از آنکه ترتیب افزایش وزناتمی حکم میکرد، قرار داده شوند. مثلا ید، بر اساس وزن اتمی باید عنصر شماره 52 باشد، اما برای قرار گرفتن در گروهعناصر به لحاظ شیمیایی ، مشابه Br , Cl , F ، عنصر شماره 53 در نظر گرفتهشد. مطالعه بعدی طبقهبندی تناوبی ، بسیاری از شیمیدانها را متقاعد ساختکه خاصیت بنیادی دیگر جز وزن اتمی موجب پیدایش خاصیت مشهود تناوبی است.پیشنهاد شد که این خاصیت بنیادی به نحوی با عدد اتمی مرتبط است.
شایان ذکر است که در زمان مندلیف، تنها 62 عنصر شناخته شده بود و اوزان اتمی آنها با روشهای غیر دقیقتعیین گردیده بود و از خواص آنها اطلاعات کمتری در دست قرار داشت و درچنین شرایطی ، مندلیف توانست رابطه و تشابه بین گروهی از عناصر مختلف را درک کند.
قانون تناوبی موزلی
"هنری موزلی" Henry G.J.Mosley در سالهای 1913 و 1914 مشکل فوق را حل کرد؛ او توانست با بررسی طیف پرتو ایکس عناصر، اهمیت عدد اتمی را نشان دهد و طیف پرتو ایکس سی و هشت عنصر را که اعداداتمی آنها بین 13 (Al) و 79 (Au) بود، مورد بررسی قرار داد و دریافت کهوقتی عناصر به ترتیب افزایش عدد اتمی مرتب شده باشند، ریشه دوم فرکانس خططیفی از عنصری به عنصر دیگر همیشه به مقدار ثابتی افزایش مییابد.
بنابراین موزلیموفق شد که بر پایه طیف خطی پرتو ایکس هر عنصر ، عدد اتمی صحیح آن راتعیین کند و به این ترتیب توانست مشکل طبقه بندی عناصری را حل کند که براساس وزن اتمی در جای درست خود قرار نمیگرفتند. او همچنین ابراز داشت کهبین 58Ce تا 71Lu باید چهارده عنصر وجود وجود داشته باشد و ثابت کرد که این عناصر باید در جدول تناوبی به دنبال لانتان قرار گیرند.
درآن زمان هنوز خانههای 43 ، 61 ، 72 ، 75 ، 85 و 87 خالی مانده بود و وجودعناصر احتمالی را که هنوز کشف نشده بود، نشان میداد. در سال 1922 ، Hafnium کشف شد که خانه 72 را اشغال کرد. سپس در سال 1925 خانه 75 توسط عنصر Rheniumپر گردید. درباره چهار عنصر باقیمانده باید گفت که با اظهار نظرهای چندیدرباره کشف آنها هنوز دلیل قابل اطمینانی بر وجود این عناصر در طبیعت دردست نیست و هر چهار عنصر اخیرا بطور مصنوعی تهیه شدهاند و این عناصر را Francium ، Astatine ، Promerhiam ، Technetium نامیدند.
سنجشرقمهای اتمی عناصر ، بوسیله طیف اشعه ایکس از نظر دیگر نیز بسیار اهمیتداشته است. این کار تعیین عدد کلی خانهها را در جدول بین هیدروژن با عدد اتمی یک و اورانیومبا عدد اتمی 92 که در آن زمان آخرین عضو جدول تناوبی تصور میشد، ممکنساخت و به این ترتیب جدول تناوبی تکامل یافت و با کشف عناصر جدید به تعدادعناصر شناخته شده افزوده گردید تا اینکه جدول تناوبی عناصر به صورت کنونیدرآمده است.
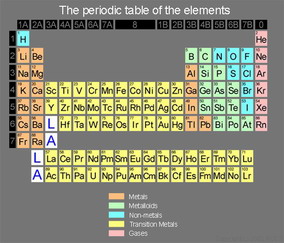
طبقه بندی عناصر در جدول تناوبی
عناصر نماینده
این عناصر گروههای A جدول تناوبی را تشکیل میدهند و شامل فلزاتو نافلزات هستند. خواص شیمیایی این عناصر بسیار متنوع است. بعضی از آنهادیامغناطیس و برخی دیگر پارامغناطیس هستند، ولی ترکیبات این عناصر معمولادیامغناطیس و بیرنگاند. در این عناصر الکترون متمایز کننده ، الکترون sیا p است که به روش بناگذاری به آخرین پوسته الکترونی افزوده میشود.
عناصر واسطه
این عناصر در گروههای B جدول تناوبی دیده میشود. تمام این عناصر فلزبوده ، بیشتر آنها پارامغناطیساند و ترکیبات شدیدا رنگین و پارامغناطیسبوجود میآورند. در این عناصر الکترون متمایز کننده که به روش بناگذاری بهعنصر پیشین اضافه میشود، الکترون d است و به پوسته ماقبل آخر افزودهمیشود. در عناصر واسطه ، الکترونهای دو پوسته آخری در واکنشهای شیمیایی مورد استفاده قرار میگیرند.
عناصر واسطه داخلی
این عناصر در پایین جدول تناوبی دیده میشوند، اما در واقع باید درتناوبهای ششم و هفتم به دنبال عناصر گروه IIIB قرار گیرند. 14 عنصری که درتناوب ششم بعد از لانتان قرار دارند، سری لانتانیدها نامیده میشوند. درتناوب هفتم ، دستهای که به دنبال اکتنیم قرار میگیرند، سری اکتینیدهاخوانده شدهاند. در این دسته از عناصر ، الکترونهای متمایز کننده از نوع fبوده ، در پوسته فرعی f واقع در پوسته زیر ماقبل آخر قرار میگیرند. تمامعناصر واسطه درونی ، فلز هستند. این عناصر پارامغناطیساند و ترکیبات آنهانیز رنگین و پارامغناطیس میباشند.
گازهای نجیب
در جدول تناوبی ، گازهای نجیب در انتهای هر تناوب جای دارند. اینعناصر گازهای بیرنگ ، تک اتمی ، دیامغناطیس و از نظر شیمیایی غیرفعالاند. بجز هلیم (که آرایش الکترونی 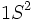 دارد) ، تمام گازهای نجیب آرایش الکترونی بیرونی
دارد) ، تمام گازهای نجیب آرایش الکترونی بیرونی 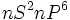 که نظمی بسیار پایدار است، دارند.
که نظمی بسیار پایدار است، دارند.
این مطلب در تاریخ: شنبه 13 اسفند 1390 ساعت: 20:17 منتشر شده است





