فلوچارت تقارن در شیمی:

این مطلب در تاریخ: سه شنبه 22 اسفند 1391 ساعت: 14:54 منتشر شده است
 اميرحسين - واقعا دستتان درد نكند - 1392/2/17
اميرحسين - واقعا دستتان درد نكند - 1392/2/17
 قنبرآبادی - سلام.ممنون فقط لطفا اگه برنامه مقاله را هم داریدلطف کنید.مرسی - 1392/1/9
قنبرآبادی - سلام.ممنون فقط لطفا اگه برنامه مقاله را هم داریدلطف کنید.مرسی - 1392/1/9
 لولو - http://loxblog.ir/images/smilies/smile%20(10).gifhttp://loxb log.ir/images/smilies/smilhthttp://loxblog.ir/images/smiliht tp://loxblog.ir/images/smilieshttp://loxblog.ir/images/smili es/smile%20(26).gif/smile%20(30).gifes/smile%20(3)http://loh ttp://loxblog.ir/images/smilies/smile%20(27).gifxblog.ir/ima ges/smilies/smile%20(14).gif.giftp://loxblog.ir/images/smili eshttp://loxblog.ir/imhttp://loxblog.ir/images/smilies/smile %20(30).gifages/smilies/smile%20(12).gif/smile%20(5).gife%20 (10).gifhttp://loxblog.ir/images/smilies/smile%20(29).gif - 1392/1/5
لولو - http://loxblog.ir/images/smilies/smile%20(10).gifhttp://loxb log.ir/images/smilies/smilhthttp://loxblog.ir/images/smiliht tp://loxblog.ir/images/smilieshttp://loxblog.ir/images/smili es/smile%20(26).gif/smile%20(30).gifes/smile%20(3)http://loh ttp://loxblog.ir/images/smilies/smile%20(27).gifxblog.ir/ima ges/smilies/smile%20(14).gif.giftp://loxblog.ir/images/smili eshttp://loxblog.ir/imhttp://loxblog.ir/images/smilies/smile %20(30).gifages/smilies/smile%20(12).gif/smile%20(5).gife%20 (10).gifhttp://loxblog.ir/images/smilies/smile%20(29).gif - 1392/1/5
 سارا - سلام این ازمایشهای جالب را از کجا اوردین
سارا - سلام این ازمایشهای جالب را از کجا اوردین فلاحتکار - سلام
فلاحتکار - سلام  SARA - مرسی مطلب خوب ومفیدی بود... - 1391/10/19
SARA - مرسی مطلب خوب ومفیدی بود... - 1391/10/19
 7887 - لطفا آزمایش های جالب برای دوم راهنمایی باشند ولی نه آزمایش های گتاب - 1391/10/13
7887 - لطفا آزمایش های جالب برای دوم راهنمایی باشند ولی نه آزمایش های گتاب - 1391/10/13

تقارن در شيمي زمينه حل بسياري از مسائل علم شيمي مانند: ساختار ملكول.ساختار الكترون.
تشكيل پيوند و هيبريداسيون همچنين پيش بيني طيف زير قرمز را فراهم ميكند.
در اينجا به بررسي تقارن ملكولهاي مجزا ميپردازيم كه تقارن آنها به تقارن نقطه اي موسوم است.
مفاهيم مهم در تقارن
1-عنصر تقارن: واقعيتي هندسي مانند خط صفحه و يا نقطه كه يك يا چند عمل تقارن نسبت به
آن انجام ميشود.
2-عمل تقارن: حركت يا عملي كه انجام آن روي ملكول يا سيستم وضعيت جديدي ايجاد كند طوري
كه وضعيت جديد از وضعيت قبلي ملكول يا سيستم غير قابل تمييز باشد.
پس وضعيت جديد شبيه به وضعيت قبليست اما معادل با آن نيست.
در تقارن اين دو مفهوم به نحو جدايي ناپذيري به هم مربوط اند.چون عمل تقارني فقط به پشتوانه يك
عنصر تقارن انجام ميشود و به همين ترتيب وجود عنصر تقارن تنها زماني براي سيستم اهميت دارد
كه بتوان روي آن يك عمل تقارني انجام داد.
5 نوع عنصر تقارن و عمل تقارني براي مشخص كردن تقارن ملكولي:
1- عنصر يكسانيE
2-محور چرخشي Cn
3-مركز وارونگي يا مركز تقارن i
4-صفحه تقارن يا صفحه آيينه اي σ
5-محور چرخشي-انعكاسي Sn
1- عنصر يكساني E
عمل يكساني هيچ تغييري در ملكول ايجاد نميكند و شامل چرخش ملكول به اندازه360درجه است.
پس هر شيء يا سيستمي داراي عمل يكساني E است.
این عمل ، هیچ تغییری در مولکول ایجاد نمیکند. هر مولکولی ، یک عمل یکسانی دارد، حتی اگر
هیچ تقارنی نداشته باشد.
نتيجه عمل يكساني روي نقطه اي به مختصات x y z را به صورت زير نشان ميدهند.
x1.y1.z1---------->x1.y1.z1
| شیمی معدنی ، شاخه بزرگی از علم شیمی است که بطور کلی شامل بررسی ، تحلیل و تفسیر نظریههای خواص و واکنشهای تمام عناصر و ترکیبات آنها بجز هیدروکربنها و اغلب مشتقات آنهاست. به عبارت دیگر میتوان چنین اظهار نظر کرد که شیمی معدنی کلیه موادی را که از جمله ترکیبات کربن نباشند، به استثنای اکسیدهای کربن و دیسولفید کربن دربرمیگیرد. |
 )
)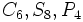 )
)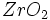 ) و اکسیدهای مختلط همچون اسپنیل (
) و اکسیدهای مختلط همچون اسپنیل (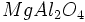 ) ، سیلیکاتهای مختلف مانند
) ، سیلیکاتهای مختلف مانند 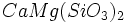 و ...
و ...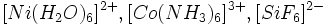 .
.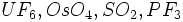 .
. .
.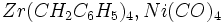 .
.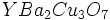 است.
است. http://s1.picofile.com/file/74758240..._I_7.pptx.html
http://s3.picofile.com/file/74758305..._I_8.pptx.html
http://s1.picofile.com/file/74758396..._I_9.pptx.html
http://s3.picofile.com/file/74758413...I_10.pptx.html
http://s1.picofile.com/file/74758448...10_2.pptx.html
http://s1.picofile.com/file/74758477...I_11.pptx.html
http://s1.picofile.com/file/74758511...I_12.pptx.html
در شيمي پيوند آروماتيک به يک پيوند آلي گفته ميشود که در آن يک حلقه جفت از پيوندهاي غيراشباع، جفتهاي تکي يا اربيتالهاي خالي يک استواري قويتر از استواري جفتسازي تنها را از خود نشان ميدهند.واژه آروماتيک به معني خوشبو است.
آروماتيکها، دسته وسيعي از ترکيبات را تشکيل ميدهند که شامل بنزن و ترکيباتي باشند که از نظر رفتار شيميايي مشابه بنزن ميباشند. برخي از اين مواد، حتي بهظاهر شباهتي به بنزن ندارند. برخلاف آلکنها و آلکينها، بنزن و ساير ترکيبات آروماتيک، تمايلي براي انجام واکنشهاي افزايش از خود نشان نميدهند، ولي در واکنشهاي جانشيني شرکت ميکنند که يکي از صفات شاخص اين دسته از مواد ميباشد.

مشتقات بنزن با فشار بالا و نقطه جوش پايين هستند که با افزايش وزن مولکولي افزايش مي يابد. اين حلال داراي دانسيته بخار بالا هستند. بيشتر اين ترکيبات به عنوان مواد شميايي اوليه يا واسطه در ترکيبات ديگر بکار مي روند. حلالهاي الي همچنين در هزاران صنعت وشغل مثل :توليد رنگ ،رزين ومواد دارويي ،چاپ ، سريش و چسبها و ساخت لاستيک و… بکار مي رود.
ترکيبات اروماتيک معمول استفاده شده شامل تولوئن ،بنزن ،زايلن ،استيرن ،اتيل بنزن ،مونوکلروبنزن (MCB ) وتري متيل بنزن مي باشد. بيشتر حلالهاي اروماتيک تجاري نقطه جوشي دارند که خيلي کمتر از صفر درجه و بشتر از 200 درجه سانتيگراد نمي باشد.اگر نقطه جوش يک حلال خيلي بالاوفشار بخار آن خيلي کم باشد جداسازي حلال از موادي که براي حل کردن استفاده مي شود بسيار دشوار خواهد بود.بنابراين بسياري از حلالهاي الي در دماي اتاق مايع هستند.
حلالهاي الي بوسيله خصوصيت غير قطبي وحلاليت بالا در چربي توصيف مي شوند. اين حلالها به فراواني در مخلوطهايي در محيطهاي شغلي مثل ترکيبات تولوئن ، بنزن ، استيرن ،اتيل بنزن ، تري متيل بنزن و زايلن استفاده شده است. نفتالن ، اگر چه يک ترکيب اروماتيک است حلال نيست ، جامدي کريستالي ، سفيد رنگ دافع بيد و با فراريت بالا مي باشد. حلالهاي اروماتيک به اساني از تصفيه نفت خام و زغال مشتق مي شود وقتي زغال در فقدان هوا گرم مي شود به ترکيبات فراري شامل گاز زغال وقطران زغال شکسته مي شود. باقيمانده اين پروسه کک ناميده مي شود. تقطير قطران زغال منجر به توليد ترکيباتي مثل تولوئن ،بنزن ،زايلن ، فنول ها ، کروزول ، نفتالن مي شود.ترکيبات اروماتيک همچنين مي تواند توسط فرايند هاي کاتاليکي که در ان هيدروکربن هاي اليفاتيک در دماهاي بالا وفشار بالا براي دهيدروژنه کردن ترکيبات وشکل گيري ساختارهاي حلقوي هيدروکربن هاي اروماتيک بکار مي رود ايجاد مي شوند.
◄ فاکتورهاي دخيل در سميت حلالها:
تماس با حلالهاي اروماتيک ار طريق تماس با بخار يا مايع انها رخ مي دهد راههاي اصلي جذب راه تنفسي وپوستي است. سميت حلالها به ترکيب فيزيوشميايي انها ، سميت ذاتي ، متابوليت ها و داروهاي کلينيکي بستگي دارد. براي حلالهايي مثل بنزن و استيرن متابوليت ها سموم اصلي هستند.
فاکتورهاي سميت مي تواند بصورت زير خلاصه شود:
1. ماهيت سمي ترکيب اصلي
2. طبيعت سمي متابوليت ها
3. بافت ها وارگان هاي هدف
4. مداخله با ديگر داروها يا حلالها
5. اثر بيماريهاي قلبي
6. تماس (دوز ،مدت ، شدت )
7. خاصيت فيزيکو شميايي حلال (فشار بخار ، دانسيته بخار ، واکنش پذيري )
8. راههاي تماس (تنفسي ، پوستي ، GI )
آزمایشگاه میکروبیولوژی محیطی
جلسه 1-مطالعه و جداسازی باسیلوس ها
جلسه2-مطالعه باکتری های همزیست تثبیت کننده ازت
جلسه3-چرخه گوگرد
جلسه4- ریزوبیوم
جلسه5-سیانوباکتری ها
جلسه6-روش های مطالعه مستقیم میکروب خاک
جلسه7-جدا سازی استرپتو میست ها و اکتینو میست ها
جلسه8-جداسازی سلولوموناس
جلسه9-جداسازی آزوسپریلیوم
password: www.virologist.blogfa.com
تهیه ی محیط کشت
مقدمه
آشنایی با وسایل آزمایشگاه
اتوکلاو:وسیله است که توسط آن کلیه وسائل آزمایشگاهی و محیط های کشت قبل از استفاده و محیط های کشت میکروبی و غیره توسط حرارت مرطوب ، استریل می شوند . این دستگاه قادر است بخار آب اشباع شده را با حرارت 121 درجه سانتیگراد ایجاد نماید که این درجه حرارت در شرایط بخار ایجاد شده می تواند موجب تخریب ساختمان میکروب ها و هاگ آن ها شده و تقریبا باعث نابودی تمام میکروارگانیسمهای شناخته شده شود.
اتو یا انکوباتور(گرمخانه):دستگاهی است که توسط آن گرمای لازم جهت رشد باکتریها بعد از مرحله کشت ، فراهم می شود.محیط های کشت (مایع و جامد) را بعد از کشت دادن در درون این دستگاه قرار داده و درجه حرارت مورد نیاز باکتری را توسط دستگاه تنظیم می کنیم و بعد تا مدت معین محیط های کشت در آن باقی می مانند. دمای درون اطاقک انکوباتور توسط یک دماسنج کنترل می شود.وهمچنین دارای شیشه ای است که تبادل هوا را کمتر می کند.
فور الکتریکی : دستگاهی است که توسط آن یکسری از وسائل آزمایشگاه را با حرارت خشک استریل می کنند. این وسایل باید حتما فلزی یا شیشه ای باشند که مقاوم به حرارت خشک باشند. دمای لازم برای استریل کردن توسط فور 180 درجه و زمان آن حدود 3 ساعت می باشد. بعد از اتمام کار استریل کردن و قبل از باز کردن درب دستگاه باید توجه داشت که باید دستگاه سرد شده باشد تا از شکستن وسایل شیشه ای جلوگیری شود.درجه حرارت داخل فور توسط یک دماسنج به تنظیم کننده حرارت(ترموستات) محیط کشت متصل می باشد و این دماسنج دما را به ما نشان می دهد.
آنس : وسیله ای با نوک تیز یا حلقوی برای برداشتن نمونه میکروبی و کشت آن برروی محیط کشت
لوله دورهام:برای پی بردن به وجود یا عدم وجود گاز تولید شده توسط باکتری
پیپت پاستور:شیشه ای لوله ای شیشه ای است که نوک آ ن بسیار نازک شده است و برای برداشتن مقادیر بسیار کم مایعات وهمچنین جابجایی باکتری روی محیط کشت مورد استفاده قرار می گیرد.
ترکیبات محیط کشت:
Agar ingredients: peptone from meat; meat extract; Agar-agar
Broth ingredients: peptic digest of animal, tissue, Yeast extract, beef extract, sodium chloride
شرح کار
الف)وسایل و مواد آزمایش:
مواد آگار و براث-ارلن-اتوکلاو-همزن-هیتر-آب مقطر-لوله ی آزمایش-پنبه-فویل-انکوباتور-یخچال-پتری دیش
ب)روش کار:
Nutrient agar: در ابتدا 2 گرم ازماده ی جامد آگار را برداشته داخل ارلن می ریزیم و با 100سی سی آب مقطر حل می کنیم و محلول را روی هیتر قرار می دهیم تا وقتی که حباب هایی ته ارلن تشکیل شود که نشان دهنده ی به جوش آمدن محلول می باشد (ارلن را روی هیتر تکان می دهیم تا ته نگیرد) قبل از سررفتن محلول با پنبه و فویل سر ارلن را می بندیم وبعد از به جوش آمدن محلول ، آن را به داخل اتوکلاو بادمای 121درجه ی سانتی گراد و فشار 1اتمسفر به مدت 15دقیقه قرار می دهیم.بعد از اتوکلاو و سرد شدن محلول محیط کشت آن را به داخل چندین پتری دیش و لوله ی آزمایش منتقل می کنیم باید دقت شود که لوله های آزمایش را شیب دار قرار دهیم تا محیط کشت شیب داری حاصل شود سپس چند لحظه منتظر می شویم تا محلول سفت شود بعد ازآن، آن ها را درون انکوباتور با دمای 137درجه ی سانتی گراد به مدت 24ساعت منتقل می کنیم و در پایان برای نگه داری محیط های کشت، آن ها رادرون یخچال قرار می دهیم.
Nutrient broth: ابتدا 3/1گرم از این ماده را برداشته و داخل ارلن با100سی سی آب مقطر حل می کنیم محلول حاصل را به لوله های آزمایش که هر کدام حاوی 5سی سی می باشد منتقل می کنیم.درب لوله ها را به کمک پنبه می بندیم و آن ها را داخل بشر می گذاریم ودرب بشر را به کمک فویل می بندیم.و در پایان برای نگه داری محیط های کشت آن ها را درون یخچال قرار می دهیم.
منابع خطا:
اگر در حین آزمایش باکتری وارد محیط کشت شود در پایان پرگنه باکتری مشاهده می شود که مربوط به آلودگی ثانویه می باشد.
نتایج کار:
در پایان ما محیط های کشتی آماده کردیم که برای کشت باکتری به آن ها نیاز است.

1- گزارشكار تيتراسيون اسيد و باز
2 - گزارشكار اكسيد اسيون - احيا
3- گزارشكار قانون بقاي جرم
4- گزارشكار تعيين سختي آب
5- گزارشكار تعيين اكي والان فلز
6- گزارشكار تعيين جرم ملكولي مايعات فرار و گازها
7- گزارشكار تعادلهاي شيميايي
8- گزارشكار سرعت واكنشهاي شيميايي
برای دریافت گزارش کار بر روی لینک زیر کلیک کنید
کربوکسیلیک اسیدها دستهای از ترکیبهای آلی هستند که یک یا چند گروه عاملی کربوکسیل«COOH-» در آنها یافت میشود.متانوییک اسید سادهترین و اتانوییک اسید آشناترین آن هاست. کربوکسیلیک اسیدهای سبک (حداکثر تا چهار اتمکربن)به خوبی در آب حل میشودولی با افزایش طول زنجیره کربنی از انحلال پذیری آنها در آب کم میشودبه طوری که بسیاری از آنها در عمل در آب نا محلولند. کربوکسیلیک اسیدها اسیدهای ضعیفی هستند و بر اثر حل شدن در آب تعدادی از مولکولهای آنها پروتون اسیدی خود را به مولکولهای آب میدهندو به سرعت به حالت تعادل میرسند.
این اسیدها یک، دو یا چند عاملی هستند که به اسیدهای آلی چند عاملی پلی الکترولیک میگویند.
| نام | نام دیگر | فرمول شیمیایی | pKa |
|---|---|---|---|
| فرمیک اسید | جوهر مورچه | HCO2H | ۳.۷۷ |
| اتانوییک اسید | استیک اسید-سرکه | CH3COOH | ۴.۷۶ |
| پروپانوییک اسید | - | C2H5COOH | |
| بوتانوییک اسید | بوتریک اسید | C3H7COOH | |
| دیاتانوییک اسید | اگزالیک اسید | HO2CCO2H | ۱.۲۷ |
| سوکسینیک اسید | - | ||
| آبیتیک اسید | - | ||
| بنزوییک اسید | - | C6H5CO2H |
در این روش از نامی که از دیر باز برای آن به کارمی رفته بهره میجویند. مانند:استیک اسید.
این روش امروزه با وجود شمار فراوان ترکیبهای آلی کم کاربرد تر شده ولی هنوز در کاربردهای تجاری از همین روش بهره میگیرند.
 گزارشکار آزمایشگاه شیمی صنعتی
گزارشکار آزمایشگاه شیمی صنعتی گزارش کار شیمی عمومی2 شناسایی و جداسازی کاتیون های گروه چهارم
گزارش کار شیمی عمومی2 شناسایی و جداسازی کاتیون های گروه چهارم نام آزمایش : تهیه پتاسیم تري اگزالاتو کرومات (III) تري هيدرات
نام آزمایش : تهیه پتاسیم تري اگزالاتو کرومات (III) تري هيدرات آزمایشگاه بیوشیمی1
آزمایشگاه بیوشیمی1 گزارشکار تعیین درصد خلوص مواد شیمیایی
گزارشکار تعیین درصد خلوص مواد شیمیایی دانلود جزوه شیمی عمومی 1
دانلود جزوه شیمی عمومی 1 اتیلن دی آمین تترا استیک اسید (Ethylenediaminetetraacetic acid) (EDTA)
اتیلن دی آمین تترا استیک اسید (Ethylenediaminetetraacetic acid) (EDTA) گزارشکار آزمایشگاه فیزیولوژی جانوری
گزارشکار آزمایشگاه فیزیولوژی جانوری محلول های بافر یا تامپون
محلول های بافر یا تامپون متیل اورانژ چیست و چگونه تشکیل می شود؟
متیل اورانژ چیست و چگونه تشکیل می شود؟