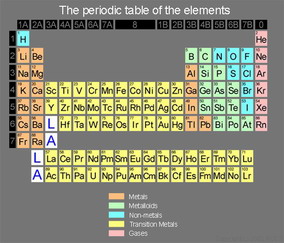
جدول تناوبی مندلیف
چند میلیارد سال پیش با انفجار بزرگ (BIG BANG) جهان بوجود آمد. جهانی که در ابتدا بسیار داغ بود (107K) اجازه به هم پیوستن ذرات اتم و ایجاد اتمها را نمی داد اما کم کم اتمهای اولیه که بیشتر شامل هیدروژن (89%) و هلیم (11%) بودند تشکیل شدند که با سرد شدن تدریجی دمای جهان و به هم پیوستن این اتمها به هم و ایجاد سحابی ها و ستاره ها این اتمها در واکنشهای هم جوشی با آزاد کردن مقادیر بسیار زیادی انرژی به عناصر سنگین تر تبدیل شدند.
از چند قرن پیش که کم کم بشر عناصر را شناخت و تعداد عناصر شناسایی شده افزایش یافت نیاز به طبقه بندی آنها احساس گردید به طوری که در ابتدا عناصر را به دو دسته فلزات و نافلزات تقسیم بندی نمودند و بعد بر اساس ترکیباتی که تشکیل می دادند آنها را تقسیم بندی کردند.
دانشمندان زیادی در دو قرن اخیر جدول های طبقه بندب عنصرها را به شکل های مختلف ارائه داده اند اما در بین آنها کار دانشمندی روسی به نام دیمتری مندلیف اعتبار و شهرت زیادی پیدا کرده طوری که هم اکنون نیز جدول تناوبی اصلاح شده ی مندلیف در کتب درسی مورد مطالعه قرار می گیرد.
جدول تناوبی عناصر شیمیایی نمایشی از عناصر شیمیایی است که براساس ساختار الکترونی مرتب شده است، بطوریکه بسیاری از خواص شیمیایی بصورت منظم در طول جدول تغییر نماید. جدول اولیه بدون اطلاع از ساختار داخلی اتمها ساخته شد: اگر عناصر را بر حسب جرم اتمی آنها مرتب نمائیم، و آنگاه نمودار خواص معین دیگر آنها را بر حسب جرم اتمی رسم نمائیم، میتوان نوسان یا تناوب این خواص را بصورت تابعی از جرم اتمی مشاهده نمود. اولین کسی که توانست این نظم را مشاهده نماید، یک شیمیدان آلمانی به نام Johann Wolfgang D?einer بود. او متوجه تعدادی تثلیث از عناصر مشابه شد:
نمونه تثلیث ها

و به دنبال او، شیمیدان انگلیسی جان الکساندر رینا نیولندز (John Alexander Reina Newlands) متوجه گردید که عناصر از نوع مشابه در فاصلههای هشت تایی یافت می شوند، که آنها را با نتهای هشتگانه موسیقی شبیه نمود، هرچند که قانون نتهای او مورد تمسخر معاصرین او قرار گرفت. سرانجام شیمیدان آلمانی لوتار میر (Lothar Meyer) و شیمیدان روسی دیمتری ایوانوویج مندلیف (Dmitry Ivanovich Mendeleev) تقریبا بطور همزمان اولین جدول تناوبی را، با مرتب نمودن عناصر بر حسب جرمشان، توسعه دادند(ولی مندلیف تعداد کمی از عناصر را خارج از ترتیب صریح جرمی، برای تطابق بهتر با خواص همسایگانشان رسم نمود – این کار بعدها با کشف ساختار الکترونی عناصر در اواخر قرن نوزدهم و اوایل قرن بیستم توجیه گردید). فهرست عناصر بر اساس نام، علامت اختصاری و عدد اتمی موجود میباشد.

تعداد لایه الکترون در یک اتم تعیین کننده ردیفی است که در آن قرار می گیرد. هر لایه به زیرلایه های متفاوتی تقسیم می شود، که هر اندازه عدد اتمی افزایش می یابد، این لایه ها به ترتیب زیر:
1s
2s 2p
3s 3p
4s 3d 4p
5s 4d 5p
6s 4f 5d 6p
7s 5f 6d 7p
8s 5g 6f 7d 8p
…
براساس ساختار جدول پر می شوند. از آنجائیکه الکترونهای خارجی ترین لایه، خواص شیمیایی را تعیین می نمایند، این لایه ها در میان گروهای یکسان مشابه اند.عناصر همجوار با یکدیگر در یک گروه، علیرغم اختلاف مهم در جرم، دارای خواص فیزیکی مشابه می باشند. عناصر همجوار با یکدیگر در یک ردیف دارای جرم های مشابه ولی خواص متفاوت می باشند.
برای مثال، عناصر بسیار نزدیک به نیتروژن (N) در ردیف دوم کربن (C) و اکسیژن (O) می باشند. علیرغم تشابه آنها در جرم ( که بصورت ناچیزی در واحد جرم اتمی تفاوت دارند)، دارای خواص بینهایت متفاوتی هستند، همانطور که با بررسی فرمهای دیگر می توان ملاحظه نمود: اکسیژن دو اتمی یک کاز است که سوختن را تشدید می نماید، نیتروژن دو اتمی یک گاز است که سوختن را تشدید نمی کند، و کربن یک جامد است که می تواند سوزانده شود( بله، میتوان الماس را سوزاند!).
در مقایسه، عناصر بسیار نزدیک به کلر (Cl) در گروه یکی مانده به آخر در جدول «هالوژنها) فلوئور( F) و برم( Br) میباشند. علیرغم تفاوت فاحش جرم آنها در گروه، فرمهای دیگر آنها دارای خواص بسیار مشابه می باشند: آنها بسیار خورنده (بدین معنی که تمایل خوبی برای ترکیب با فلزات، برای تشکیل نمک هالاید فلز)؛ کلر و فلوئور گاز هستند، درحالیکه برم یک مایع با تبخیر بسیار کم میباشد؛ کلر و برم بسیار رنگی هستند.
مندلیف و لوتار میر در مورد خواص عنصرها و ارتباط آنها بررسی های دقیق تری انجام دادند و در سال ۱۸۶۹م به این نتیجه رسیدند که خواص عنصرها تابعی تناوبی از جرم آنهاست.
به این معنا که اگر عنصرها را به ترتیب افزایش جرم اتمی مرتب شوند نوعی تناوب در آنها اشکار میگرددوپس ازتعداد معینی از عنصرها عنصرهایی با خواص مشابه خواص پیشین تکرار می شوند .
مندلیف در سال ۱۸۶۹ بر پایه ی قانون تناوب جدولی از ۶۳عنصر شناخته شده ی زمان خود منتشر کرد .در فاصله ی بین سالهای ۱۸۶۹ تا ۱۸۷۱م مندلیف هم مانند لوتار میر با بررسی خواص عنصرها و ترکیب های آنها متوجه شد که تغییرهای خواص شیمیا یی عنصرها مانند خواص فیزیکی آنها نسبت به جرم اتمی روند تناوبی دارد.از این رو جدول جدیدی در ۸ ستون و۱۲سطر تنظیم کرد.او با توجه به نارسایی های جدول نیو لندز و لوتار میر و حتی جدول قبلی خود جدولی تقریبابدون نقص ارایه دادکه فراگیر وماندنی شد.
شاهکارهای مندلیف در ساخت شهرک عناصر
روابط همسایگی : دانشمندان پیش از مندلیف در طبقه بندی عناصر هر یک را جداگانه و بدون وابستگی به سایر عناصر در نظر می گرفتند.اما مندلیف خاصیتی را کشف کرد که روابط بین عنصرها را به درستی نشان میدادو ان را پایه تنظیم عناصر قرار داد.
وسواس وی : او برخی از عناصر را دوباره بررسی کرد تا هر نوع ایرادی را که به نادرست بودن جرم اتمی از بین ببرد.در برخی موارد به حکم ضرورت اصل تشابه خواص در گروهها را بر قاعده افزایش جرم اتمی مقدم شمرد.
واحدهای خالی : در برخی موارد در جدول جای خالی منظور کردیعنی هر جا که بر حسب افزایش جرم اتمی عناصر باید در زیر عنصر دیگری جای می گرفت که در خواص به ان شباهتی نداشت ان مکان را خالی می گذاشتو ان عنصر را در جایی که تشابه خواص رعایت میشد جای داد.این خود به پیش بینی تعدادی ا زعنصرهای ناشناخته منتهی شد.
استقبال از ساکنان بعدی : مندلیف با توجه به موقعیت عنصرهای کشف نشده و با بهره گیری از طبقه بندی دوبرایزتوانست خواص آنها را پیش بینی کند.برای نمونه مندلیف در جدولی که در سال ۱۸۶۹ تنظیم کرده بودمس و نقره وطلا را مانند فلزی قلیایی در ستون نخست جا داده بود اما کمی بعد عناصر این ستون را به دو گروه اصلی و فرعی تقسیم کرد.سپس دوره های نخست و دوم و سوم هر یک شامل یک سطر و هر یک از دوره های چهارم به بعد شامل دو سطر شده وبه ترتیب از دوره های چهارم به بعد دو خانه اول وشش خانه اخر از سطر دوم مربوط به عناصر اصلی آن دوره و هشت خانه باقی مانده ی سطر اول و دو خانه اول سطر دوم مربوط به عناصر فرعی بود.
ساخت واحد مسکونی هشتم : مندلیف با توجه به این که عناصراهن وکبالت ونیکل وروتینیم ورودیم وپالادیم واسمیم وایریدیم وپلاتینخواص نسبتا با یکدیگر دارند این عناصر را در سه ردیف سه تایی و در ستون جداگانه ای جای دادو به جدول پیشین خود گروه هشتم ا هم افزود.
در آن زمان گازهای نجیب شناخته نشده بوداز این رودر متن جدول اصلی مندلیف جایی برای این عناصر پیش بینی نشد. پس از ان رامسی و رایله در سال ۱۸۹۴ گاز ارگون را کشف کردند و تا سا ل ۱۹۰۸ م گازهای نجیب دیگرکشف شد و ظرفیت شیمیایی آنها ۰ در نظر گرفته شدو به گازهای بی اثر شهرت یافتند.
آسانسور مندلیف به سوی آسمان شیمی
جدول مندلیف در تنظیم و پایدار کردن جرم اتمی بسیاری از موارد مندلیف نادرست بودن جرم اتمی برخی از عناصر را ثابت و برخی دیگر را درست کرد .جدول تناوبی نه تنها به کشف عنصرهای ناشناخته کمک کرد بلکه در گسترش و کامل کردن نظریه ی اتمی نقش بزرگی بر عهده داشت و سبب اسان شدن بررسی عناصر و ترکیب های آنها شد.
مجتمع نیمه تمام
جدول تناوبی با نارسایی هایی همراه بود که عبارتند از :
4- جای هیدروژن در جدول بطور دقیق مشخص نبود .گاهی ان را بالا ی گروه فلزهای قلیایی و گاهی بالای گروه های گروه هالوژن ها جا میداد.
2- در نیکل و کبالت که جرم اتمی نزدیک به هم دارند خواص شیمیایی متفاوت است و با پایه قانون تناوبی ناسازگاری دارد.
3- کبالت را پیش از نیکل و همچنین تلور را پیش از ید جای داد که با ترتیب صعودی جرم اتمی هم خوانی نداشت .با پیش رفت پژوهش ها و با کشف پرتوایکس و عنصرهاو بررسی دقیق طیف آنها عدد اتمی کشف و اشکار شد و عناصر بر حسب افزایش عدد اتمی مرتب و نار سایی های جزیی موجود در جدول مندلیف از بین رفت .زیرا تغییرات خواص عناصر نسبت به عدد اتمی از نظم بیشتری برخوردارست تا جرم اتمی آنها .
4- سال پس از نشر جدول مندلیف بوابو در ات به روش طیف نگاری اکا الومینیوم را کشف کرد و گالیم نامید و ۴ سال بعد نیلسون اکا بور را کشف کرد و اسکاندیم نامید و هفت سال بعد ونیکلر هم اکا سیلسیم را از راه تجربه طیفی کشف کرد و ان را ژرمانیم نامید.
تغییرات خواص عناصر در دوره ها و گروههای جدول
۱- تغییرات شعاع اتمی : در هر گروه با افزایش عدد اتمی شعاع اتمی افزایش می یابد ودر هر دوره با افزایش عدد اتمی شعاع اتمی به تدریج کوچکتر می گردد.
۲- تغییرات شعاع یونی : شعاع یون کاتیون هر فلز از شعاع اتمی ان کوچکتر و شعاع هر نا فلز از شعاع اتمی ان بزرگتر است.به طور کلی تغییرهای شعاع یونی همان روند تغییرات شعاع اتمی است.
۳- تغییرات انرژی یونش : در هر دوره با افزایش عدد اتمی انرژی یونش افزایش می یابد و در هر گروه با افزایش لایه های الکترونی انرژی یونش کاهش می یابد.
۴- تغییرات الکترون خواهی : در هر دوره با افزایش عدد اتمی انرژی الکترونخواهی افزایش می یابدودر هر گروه با افزایش عدد اتمی اصولا انرژی الکترون خواهی از بالا به پایین کم می شود .
۵- تغییرات الکترونگاتیوی : در هر دوره به علت افزایش نسبتا زیا د شعاع اتمی الکترونگاتیوی عناصر کم میشود و در هر دوره به علت کاهش شعاع اتمی الکترونگاتیوی عناصر افزایش می یابد .
۶- تغییرتعداد الکترونهای لایه ظرفیت و عدد اکسایش : در هر دوره از عنصری به عنصر دیگریک واحد به تعداد الکترون ها ی ظرفیت افزوده میشود و تعداد این الکترونها و عدد اکسایش در عنصرهای هر گروه با هم برابرند.
۷- تغییرات پتانسیل الکترودی : در ازای هردوره با افزایش عدد اتمی توانایی کاهندگی عنصرها کاهش می یابد و توانایی اکسیدکنندگی آنها افزایش می یابد .از این روفلزهایی که در سمت چپ دوره ها جای دارندخاصیت کاهندگی ونا فلزهایی که در سمت راست دوره ها جای دارندتوانایی اکسید کنندگی دارند.در موردعناصر یک گروه توانایی اکسید –کنندگی با افزایش عدد اتمی وپتانسیل کاهش می یابد.
۸- تغییرات توانایی بازی هیدروکسید : توانایی بازی هیدروکسیدعناصر در گروهها ازبالا به پایین افزایش می یابد اما در دوره از سمت چپ به راست رو به کاهش است.
۹-تغییرات دما و ذوب یا جوش : در هر دوره دمای ذوب و جوش تا اندازه ای به طورتناوبی تغییر می کند ولی این روندمنظم نیست و در موردعناصرگروهها نیز روندواحدی وجود ندارد.
(داخل پرانتز)
مندلیف چگونه جدول تناوبی عنصرها را تنظیم کرد؟
(در سال 1869 که دیمتری مندلیف روی طبقه بندی بهتر عنصرها تحقیق می کرد فقط ۶۳ عنصر شناخته شده بود او ۶۳ کارت تهیه کرد و روی هر کارت علاوه بر نام عنصر برخی خواص شناخته شده ی آن عنصر را نوشت مثل دمای ذوب و جوش و جرم اتمی و ... بعد این کارت ها را به ترتیب افزایش ویژگی های مختلف کنار هم قرار میداد مثلا یکبار به ترتیب افزایش دمای ذوب و بار دیگر به تریب افزایش ویژگی دیگر . وقتی مندلیف عنصرها را به ترتیب افزایش جرم اتمی کنار هم به صورت یک ردیف ۶۳ تایی چید به نکته جالبی بر خورد او دید که ویژگی های نوشته شده روی کارت ها ۸ تا ۸ تا تکرار می شود یعنی ویژگی های روی کارت اول مشابه کارت نهم و هفدهم و ... و کارت دوم مشابه کارت دهم و هجدهم و ... است. کار جالبی که مندلیف انجام داد این بود که ضمن رعایت افزایش تدریجی جرم اتمی عنصرها کارت هایی که ویژگی های مشابهب داشتند را زیر هم در یک ستون قرار داد تا چیزی شبیه یک جدول درست شود به نحوی که عنصرها به ترتیب افزایش جرم اتمی کنار هم قرار گرفته اند و عنصرهای یک ستون نیز خواص مشابهی دارند. این اساس کار مندلیف برای تنظیم جدول تناوبی بود.
در جدول تناوبی مندلیف فقط ۶۳ عنصر قرار داشت بنابراین بدیهی است که انتظار داشته باشیم برخی از جاهای جدول او نسبت به جدول امروزی خالی باشد در واقع مندلیف برای نظم دادن به جدول خود مجبور بود برخی از خانه های جدول را خالی نگه دارد تا عنصر های مشایه زیر هم قرار گیرند او تصور می کرد این جاهای خالی مربوط به عنصرهایی است که هنوز کشف نشده اند و حتی توانست برای آنها برخی خواصشان را پیش بینی کند چون باید خواصی بینابین عنصر بالاتر و پایین تر از خود در یک ستون داشته باشد. او همچنین از روی این جدول توانست وجود بعضی از عناصر را که تا آنروز کشف نشده بود حدس بزند و همین امر و پیش بینی های او که درست از آب در می آمد سبب شهرت زیاد او نسبت به سایر دانشمندان هم دوره اش گردید.)
جدول تناوبی امروزی
در جدول تناوبی که امروزه ما می بینیم ساختار کلی همان است که در جدول مندلف وجود داشت اما عناصر بجای جرم اتمی بر اساس عدد اتمی در جدول قرار می گیرند. البته با این تصحیح جای عنصرها عوض نمی شود
ردیفهای افقی جدول را تناوب، و ردیفهای عمودی آن را گروه می نامند و عناصر بر اساس اربیتالی از آنها که آخرین الکترون اتم در آن جا گرفته است به چهار بلوک s,p,d و f طبقه بندی می شوند. عناصر دو بلوک s و p عناصر اصلی، عناصر بلوک d عناصر واسطه و عناصر بلوک f لانتانیدها و اکتینیدها می باشند. شماره گذاری گروهها از یک تا 18 و شماره گذاری تناوب ها از یک تا 7 می باشد.
 (برای دیدن عکس در اندازه بزرگ آن را ذخیره کنید.)
(برای دیدن عکس در اندازه بزرگ آن را ذخیره کنید.)
چگونه از جدول تناوبی استفاده نمائیم؟
یک جدول تناوبی می تواند شامل اطلاعات متفاوت و متنوعی باشد که بسته به نوع کاربردی که از آن متصور است طراحی می شود، در یک جدول معمولی می توان علامت اختصاری عناصر، عدد اتمی و جرم اتمی آنها را یافت. همچنین از روی گروهی که آن عنصر به آن وابسته است خصوصیات شیمیایی آنرا حدس زد.
مثلا در گروه 1 که فلزات قلیایی جای دارند عناصر وابسته به آن فلزاتی هستند به شدت واکنش پذیر که در طبیعت بطور خالص یافت نمی شوند و برای تهیه آنه معمولا از روشهای مشکل الکترولیز استفاده میشود که در این روشها ممکن است از نمک هالوژن مذاب آنها استفاده کنند. این فلزات با آب به شدت واکنش پذیرند و تعدادی از آنها در واکنش با آب تولید مقادیر زیادی حرارت و گاز هیدروژن میکنند که گاز تولید شده در اثر حرارت آتش میگیرد و واکنش با شعله همراه خواهد بود.
همانطور که می بینید یک گروهبندی ساده خواص بسیار زیادی از مواد را در اختیار ما قرار داد.
در بعضی جدولهای تناوبی نام انگلیسی عنصر مورد نظر و (یا) آرایش الکترونی عنصر آن نیز نمایش داده شده است. بعضی از آنها شامل نیمه عمر عناصر رادیو اکتیو هستند، بعضی ممکن است شکل بلوری نقطه ذوب و جوش و خواص دیگر فیزیکی عنصر را به همراه داشته باشند.
این مطلب در تاریخ: جمعه 15 دی 1391 ساعت: 23:1 منتشر شده است







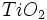 مصرفی در رنگسازی از نوع روتایل است. آناتاز را با حرارت دادن در 700-950 درجه سانتیگراد میتوان به روتایل تبدیل کرد.
مصرفی در رنگسازی از نوع روتایل است. آناتاز را با حرارت دادن در 700-950 درجه سانتیگراد میتوان به روتایل تبدیل کرد. 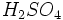 ،
، 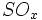 و بخار آب تولید میشود که وقتی وارد جو شوند، موجب آلودگی هوا خواهند شد. بنابراین استفاده از تصفیه کننده در کارخانهها ضروری است. از ضایعات دیگر این روش باز ، تولید اسید سولفوریک مصرف شده بدون برگشت آن به چرخه تولید میباشد.
و بخار آب تولید میشود که وقتی وارد جو شوند، موجب آلودگی هوا خواهند شد. بنابراین استفاده از تصفیه کننده در کارخانهها ضروری است. از ضایعات دیگر این روش باز ، تولید اسید سولفوریک مصرف شده بدون برگشت آن به چرخه تولید میباشد. 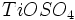
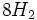
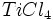 آن را تقطیر کرده و تتراکلرید تیتانیوم خالص را با اکسیژن هوا در شعلهای با دمای 1500 درجه سانتیگراد اکسید میکنند (واکنش سوختن). دراین فرایند دانههای بسیار ریز دیاکسید تیتانیوم و گاز کلر ایجاد میشود. کلر تولید شده دوباره وارد چرخه تولید میشود.
آن را تقطیر کرده و تتراکلرید تیتانیوم خالص را با اکسیژن هوا در شعلهای با دمای 1500 درجه سانتیگراد اکسید میکنند (واکنش سوختن). دراین فرایند دانههای بسیار ریز دیاکسید تیتانیوم و گاز کلر ایجاد میشود. کلر تولید شده دوباره وارد چرخه تولید میشود. 

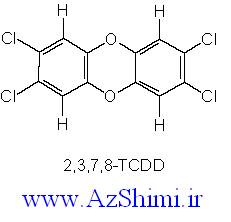
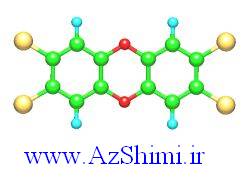

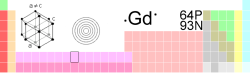


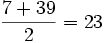
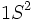 دارد) ، تمام گازهای نجیب
دارد) ، تمام گازهای نجیب 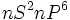 که نظمی بسیار پایدار است، دارند.
که نظمی بسیار پایدار است، دارند.
