آزمایشگاه شیمی آلی
نام و نام خانوادگی: کامران مومن زاده
استاد : دکتر قربانی
این آزمایشگاه مربوط به رشته های فنی مهندسی و علوم پایه است.
در این آزمایشگاه آزمایشهای زیر انجام می گیرد:
آزمایشگاه شیمی آلی 1
-
جلسه 1: اندازه گیری نقطه ذوب
-
جلسه 2: اندازه گیری نقطه جوش
-
جلسه 3: کروماتوگرافی
-
جلسه 4: تبلور مجدد
-
جلسه 5: استخراج
-
جلسه 6: آنالیز کیفی ترکیبات آلی ( شناسایی نیتروژن و هالوژن ها)
-
جلسه 7: تقطیر
جهت دانلود فایل کامل دستور کار روی عنوان آزمایشگاه کلیک نمایید.
این مطلب در تاریخ: یک شنبه 1 دی 1392 ساعت: 1:22 منتشر شده است
برچسب ها : آزمایشگاه شیمی آلی,
گزارش کار تبلور مجدد
استاد :سحر ملکي
نويسنده : کامران مومن زاده
تبلور مجدد
تبلور مجدد یکی از بهترین روش های خالص سازی برای خالص کردن یک جامد است.در این روش اختلاف در حلالیت سبب جدا شدن اجسام از یک دیگر و یا سبب جدا شدن ناخالصی از یک جسم میشود.در تبلور مجدد مولکول ها به تدریج از محلول جدا شده و در ردیف های منظمی به یکدیگر متصل می گردند که به عنوان شبکه شناخته می شوند. در این روش ساختمان بلورین جسم جامد را با انحلال در حلال مناسب بطور کامل از بین می برند و سپس اجازه می دهند تا بلورهای جسم به صورت یک شبکه بلوری مجددا تشکیل شوند.نا خالصی ها معمولا در محلول باقی می مانند.
تبلور مجدد شامل چندین مرحله می باشد:
۱)انتخاب حلال مناسب
۲)انحلال جسم مورد تخلیص در نقطه جوش یا نزدیک آن
۳)صاف کردن محلول داغ برای جدا نمودن ناخالصی های نامحلول
۴)تبلور از محلولی که در حال سرد شدن است
۵)جدا کردن بلورها از محلولی که در آن شناور هستند
۶)شستشوی بلورها برای خارج کردن محلولی که به آنها آغشته است
۷)خشک کردن بلورها
این مطلب در تاریخ: دو شنبه 25 آذر 1392 ساعت: 1:47 منتشر شده است
گزارش کار اندازه گیری نقطه جوش
استاد :سحر ملکي
نويسنده : کامران مومن زاده
اندازه گیری نقطه جوش
تعریف نقطه جوش:نقطه جوش دمایی است که در آن دما, فشار بخار جسم مایع با فشار اتمسفر برابر می شود.
نقطه جوش به عوامل زیر بستگی دارد:
۱_ فشار: بین نقطه جوش وفشار ارتباط مستقیم وجود دارد . اگر به تعریف نقطه جوش دقت شود فشار سیستم بالا رود نقطه جوش نیز بالا می رود و بالعکس.
تاثیر فشار بر نقطه جوش:
نقطه جوش یک مایع با تغییر فشار خارجی تغییر میکند. نقطه جوش نرمال یک مایع ، دمایی است که در آن فشار بخار مایع برابر با یک اتمسفر باشد . نقطه جوش داده شده در کتابهای مرجع ، نقاط جوش نرمال میباشند . نقطه جوش یک مایع را میتوان از منحنی فشار بخار آن بدست آورد و آن دمایی است که در آن فشار بخار مایع با فشار وارد بر سطح آن برابری میکند.
نوسانات فشار جو در یک موقعیت جغرافیایی ، نقطه جوش آب را حداکثر تا Cْ ۲ تغییر میدهد . ولی تغییر محل ممکن است باعث تغییرات بیشتر شود ، متوسط فشاری که هواسنج در سطح دریا نشان میدهد یک اتمسفر ، ولی در ارتفاعات بالاتر کمتر از این مقدار است. مثلا در ارتفاع ۵۰۰۰ پایی از سطح دریا متوسط فشاری که فشارسنج نشان میدهد atm 0.836 است و نقطه جوش آب در این فشار Cْ ۹۵٫۱ میباشد.
این مطلب در تاریخ: دو شنبه 25 آذر 1392 ساعت: 1:45 منتشر شده است
گزارش کار سنتز بنزوئیک اسید از تولوئن

بنزوئیک اسید، (C7H6O2 (C6H5COOH، یک ترکیب بلوری بی رنگ (سفید دیده میشود) است. بنزوئیک اسید سادهترین کربوکسیلیک اسید آروماتیک نیز میباشد. این ماده یک اسید ضعیف محسوب میشود. از نمکهای آن به عنوان نگهدارندههای غذایی استفاده میشود، همچنین در ساخت بسیاری از ترکیبات آلی دیگر از بنزوئیک اسید استفاده میشود.
تاریخچه
بنزوئیک اسید در قرن شانزدهم میلادی کشف شد. اولین بار شخصی به نام Nostradamus از تقطیر خشک مادهای سنتی به نام gum benzoin بدست آورد. در سال ۱۸۷۵ شخصی به نام Salkowski نیز پی به خواص ضد قارچ بنزوئیک اسید برد.
این مطلب در تاریخ: دو شنبه 25 آذر 1392 ساعت: 1:42 منتشر شده است
عنوان آزمایش: تهیه اتیلن
(برای تهیه ی اتیلن روش کارهای مختلفی را می توان در کتابهای شیمی و اینترنت پیدا کرد.اما با وجود یکسان بودن اصل روش،گاهاً دستور کار چندان ساده و ملموس نیست.در این مطلب سعی می کنم ساده ترین روش تهیه اتیلن را که در هر آزمایشگاه شیمی و با ساده ترین امکانات قابل انجام است،بنویسم.)
هدف: تهیه ی اتیلن به روش آزمایشگاهی از اتانول و شناسایی آن با محلول پتاسیم پرمنگنات
مقدمه:
اتیلن ساده ترین آلکن با فرمول C2H4 است.که گازی است بی رنگ و بسیار آتش گیر.
برای تهیه اتیلن روش های مختلفی وجود دارد که از جمله می توان کراکینگ گرمایی اتان(1) و آبگیری از الکل(اتانول) (2)را نام برد.که روش اول صنعتی و روش دوم بیشتر جنبه ی آزمایشگاهی دارد.
(1) CH3-CH3 => CH2=CH2 + H2
(2) CH3-CH2-OH => CH2=CH2 + H2O
اتیلن ( و سایر آلکن ها) با پتاسیم پرمنگنات اکسید می شوند و به این ترتیب رنگ ارغوانی آن را تغییر می دهند.همچنین با آب برم نیز واکنش داده و رنگ قرمز قهوه ای آن را از بین می برند.(روش های شناسایی آلکن ها)
(C2H4 + 2KMnO4+4H2O= 3 C2H4(OH)2 + 2KOH + 2MnO2(s
MnO2 منگنز دی اکسید (قهوه ای رنگ)
KMnO4 پتاسیم پرمنگنات (ارغوانی)
پس تغییر رنگ در طی شناسایی از ارغوانی به قهوه ای خواهد بود.
در صورت استفاده از آب برم تغییر رنگ از قهوه ای یا زرد آب برم به بی رنگ خواهد بود.
C2H4+Br2= C2H4Br2
Br2: برم( قهوه ای یا زرد رنگ)
C2H4Br2 : دی برمو اتیلن (بی رنگ)
در انتها می توان گاز خروجی از لوله ازمایش را با احتیاط آتش زد،که در این صورت گاز اتیلن شعله ور می شود.
از اتیلن در صنعت برای تهیه پلاستیک پلی اتیلن بسیار استفاده می شود.همچنین اتیلن نوعی هورمون گیاهی است که در کشاورزی برای رسیدن میوه هایی که بصورت نارس چیده می شوند(مثل موز) استفاده می شود.
روش کار:
یک تکه پنبه کوچک را به کمک همزن شیشه ای یا یک پیپت در ته یک لوله آزمایش بزرگ قرار می دهیم.چند سی سی اتانول را توسط پیپت روی پنبه ای که ته لوله آزمایش گذاشته ایم،میریزیم،به طوری که کاملاً آغشته به الکل شود.(این آغشته شدن به الکل باید در حدی باشد که موقع افقی کردن لوله آزمایش الکل از پنبه نریزد.) سپس لوله آزمایش را به صورت افقی به میله و پایه ی فلزی وصل می کنیم.به کمک اسپاتول مقداری پودر آلومینیوم اکسید(آلومین) را در وسط لوله آزمایش قرار می دهیم.در لوله آزمایش را با یک درپوش سوراخ دار بسته و لوله ی شیشه ای خمیده ای را به آن وصل می کنیم.(مطابق شکل).
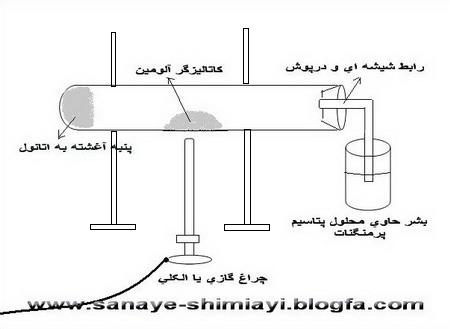
در یک بشر کوچک 50 سی سی تا نصف بشر محلول رقیق پتاسیم پرمنگنات( حدود 0.3% ) می ریزیم.و آن را زیر لوله رابط متصل به لوله آزمایش قرار می دهیم.حرارت را(در زیر قسمتی که آلومین قرار داده ایم) آغاز می کنیم.(گاهی نیز شعله را به سمت ته لوله آزمایش(جایی که پنبه را قرار داده ایم می بریم).اتانول در اثر حرارت و به کمک کاتالیزگر،آب زدایی شده و اتیلن تولید می کند.خروج گاز از لوله ی آزمایش با ایجاد حباب در محلول داخل بشر ثابت می شود.بخشی از این گاز بخار آب است و بخشی از آن گاز اتیلن.
با ورود اتیلن به داخل محلول پتاسیم پرمنگنات رنگ آن قهوه ای یا بی رنگ می شود.( بسته به اینکه محیط اسیدی باشد یا نه).
درست به همین روش می توان به جای پتاسیم پرمنگنات از آب برم نیز برای شناسایی اتیلن استفاده کرد.(بهتر است به جای برم از همن محلول پتاسی پرمنگنات برای ناسایی استفاده کرد چون برم سمی است و باعث سوختگی شدید پوست می شود)
در پایان گزارشکار باید نتیجه ی آزمایش و منابع احتمالی خطا را ذکر کرده و با توجه به مطالب گفته شده در مقدمه و متن روش کار،می توان به سوالات مربوطه پاسخ داد.
زندگینامه ی مندلیف

دیمتری ایوانویچ مندلیف شیمیدان بزرگ روسی در فوریه 1834 در شهر «توبوسك» در سیبری روسیه متولد شد او چهاردهمین فرزند خانواده بود پدرش مدیر مدرسه بود او پدر خود را در کودکی از دست داد. او در مدرسه توپولسک استعداد درخشان خود را در ریاضی و فیزیک نشان داد و عصرها بعد مدرسه در کارگاه شیشه گری به مادرش کمک می کرد مدتی بعد کارگاه شیشه گری آتش گرفت و همه سرمایه شان از دست رفت. دیمیتری برای یافتن شغل بهتر به سن پترزبورگ رفت و در آن جا به تدریس پرداخت در سال 1850 توانست بورس تحصیلی بگیرد و به تحصیل در رشته ریاضی، فیزیک و شیمی بپردازد. او خانواده خود را هم به سن پترزبورگ برد اما متاسفانه مادر و خواهرش به بیماری سل دچار شدند و جان خود را از دست دادند و او تنها شد فقر از یک سو و اندوه از سوی دیگر او را چنان بیمار ساخت که پزشکان تصور کردند او نیز به سل میتلا شده است و به او توصیه نمودند برای معالجه و استراحت به یک محل خوش آب و هوا مسافرت نماید. دیمیتری به جزایر کریمه رفت و مدتی را در آنجا ماند. پس از مدتی او سلامت روحی خود را بازیافت و به سنت پترزبورگ بازگشت...
عنوان آزمایش: خالص سازی مواد به روش استخراج
هدف: استخراج آدیپیک اسید از فاز آبی به فاز آلی(اتر)
تئوری آزمایش:
استخراج روشی است برای جداسازی که در آن جسمی از یک فاز به فاز دیگر منتقل می شود. در بعضی مواقع لازم است برای بازیابی یک ماده آلی از راههایی غیر از تقطیر استفاده شود. یکی از این راهها تماس دادن محلول آبی با یک حلال غیر قابل اختلاط با آب است. اگر حلال مناسب باشد، بیشتر مواد آلی(در اینجا آدیپیک اسید) از لایه آبی به حلال آلی (که با آب امتزاج ناپذیر است) انتقال پیدا میکند.
از نظر کمی پخش یک جسم بین دو حلال غیر قابل امتزاج را بر حسب ضریب پخش K بیان میکنند. به عبارت دیگر ضریب پخش(k) یعنی: نسبت غلظت ماده ی حل شده در حلال اول، به غلظت همان ماده در حلال دوم.
حلالی که برای استخراج انتخاب می شود باید دارای این ویژگیها باشد:
1- با حلالی که دارای ماده مورد نظر است،مخلوط نشود.(سیستم دو فازی تشکیل دهد)
2- K ماده در حلال انتخاب شده بزرگ باشد. (یعنی ماده در حلال دوم بیشتر از حلال اول محلول باشد)
3- حلال نباید ما ماده مورد نظر واکنش دهد.
4- حلال انتخاب شده به آسانی تبخیر شود.
5- حلال نباید ناخالصی ها را استخراج کند.
در استخراج مایع-مایع از قیف جدا کننده (دکانتور) استفاده می شود.قیف نباید بیشتر از سه چهارم حجم آن پر شود چون در این صورت امکان هم زدن محلول وجود نخواهد داشت.هدف از تکان دادن و هم زدن این است که سطح تماس دو حلال افزایش یابد و ماده حل شده در حلال اول در مدت زمان کمتری بتواند به حلال دوم برود.(در آن حل شود).هر چند ثانیه یک بار باید قیف را برگرداند(شیر به سمت بالا) و آن را به آرامی باز کرد تا گاز قیف خارج شود.این عمل همیشه باید انجام شود ولی در دو حالت اهمیت بیشتری دارد:
1- وقتی که حلال مورد استفاده دمای جوش پایینی داشته باشد.
2- یک محلول اسیدی با محلولی از سدیم بیکربنات استخراج شود.(در این حالت گاز کربن دی اکسید آزاد می شود)
NaHCO3 + HA = NaA + H2O + CO2
پس از تکان دادن قیف و خارج کردن گازهای آن، قیف جدا کننده را روی گیره ی حلقه ای قرار می دهند و فرصت می دهند تا فازها به خوبی از هم جدا شوند.
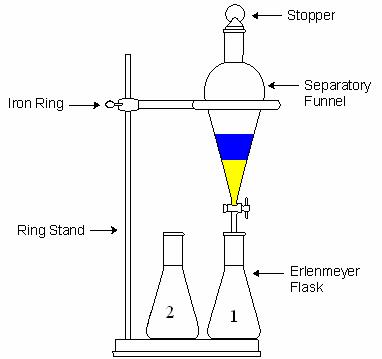
این مطلب در تاریخ: دو شنبه 25 آذر 1392 ساعت: 1:38 منتشر شده است
سنتز استانیلید
استاد : خانم سحر ملکی
نویسنده :
کامران مومن زاده
عنوان:
سنتز استانیلید
هدف:
سنتز استانیلید از آنیلین و استیک انیدرید.
ابزار و مواد لازم:
پیست آب مقطر-ارلن-استوانه مدرج-پیپت-چراغ بونزن-ترازو-کاغذ صافی-قیف شیشه ای
آنیلین-استیک انیدرید-اسید سولفوریک
تئوری آزمایش:
آنیلین
انواع آنیلین
1) تجاری
2) خالص شیمیایی
کاربرد و مصارف
1) بطور وسیع در ساخت رنگهای نساجی و مواد میانی رنگهای نساجی استفاده می شود.
2) در صنایع لاستیک سازی ، از مشتقات آنیلین به عنوان تسریع کننده و تقویت و استحکام لاستیک و ضد اکسید شدن استفاده می شود.
3) در صنایع داروسازی ، آنیلین در ساخت داروهای سولفانیل آمید و عوامل شیرین کننده سنتتیک مصرف می شود.
4) آنیلین همچنین در صنایع انفجاری از اهمیت خاصی برخوردار است و در ساخت ژلاتین و نیتروتولوئن استفاده می شود.
این مطلب در تاریخ: یک شنبه 24 آذر 1392 ساعت: 6:35 منتشر شده است
گزارش کار تهیه صابون (آزمایش صابونی شدن)
عنوان : گزارش کار تهیه صابون (آزمایش صابونی شدن)
تئوری :
می دانید ساختار یک مولکول صابون به صورت زیر است:
CH3-(CH2)n-COO- +X در صابونهای جامد X یون سدیم و در صابونهای مایع پتاسیم و آمونیوم می باشد.
در تهیه ی صابون ابتدا یون هیدروکسید باز به عنوان نوکلئوفیل (هسته دوست) به کربن گروه کربنیل حمله کرده، پس از خارج شدن یک مولکول الکل، انیون اسید به صورت هیبرید رزونانس فوق، پایدار میگردد.
الکل نقش حلال را دارد. مواد اولیه برای تولید صابون چربی (مولکول آلی و غیر قابل حل در آب) و باز (مانند سود که در آب انحلال پذیر است) می باشند. برای اینکه واکنش بین دو ماده ی اولیه ، یعنی چربی و باز، بهتر صورت گیرد باید از یک حلال استفاده کرد که هر دو ماده ی اولیه را در خود حل نماید. الکل بسیار مفید است زیرا الکل مانند C2H5OH دارای یک سر هیدروکربنی و یک سر قطبی است و می تواند هر دو ماده ی اولیه را در خود حل کرده و درنتیجه واکنش بین ان دو سریعتر و کاملتر انجام گیرد.
این مطلب در تاریخ: یک شنبه 24 آذر 1392 ساعت: 5:12 منتشر شده است
مجموعه کتابهای رشته شیمی
| طيف سنجي الكترون براي تجزيه شيميايي(ESCA ) : سلا م دوستان پاورپوينت اين مطلب در اين قسمت گذاشته شده، ... [بیشتر] (194.8 کیلوبایت) | ||||
| الكترو شيمي تجزيه اي : سلام خدمت تمام دوستان شيميستم اين كتاب توي ارشد راحت گي ... [بیشتر] (22.07 مگابایت) | ||||
| اطلاعاتي در مورد SPE : تقديم به همه دوستان شيميستم ، اگر بدردتون خورد بدردتون ... [بیشتر] (161.7 کیلوبایت) | ||||
| اسلاید آموزش مبحث هیبریداسیون : هیبریداسیون یکی از مباحث نظریه ی vespr است که آشنایی با ان ... [بیشتر] (1.05 مگابایت) | ||||
| گرافن باریکترین ضد زنگ : این text درباره گرافن است (11.6 کیلوبایت) | ||||
| فزایش استحکام گرافن با تا زدن آن : این text در مورد گرافن است (11.8 کیلوبایت) | ||||
| آموزش محلول سازی : این text در مورد طریقه محلول سازیست (173.9 کیلوبایت) | ||||
| ساخت باطری با گرافن : این text در مورد باطری جدید از گرافن است (12.3 کیلوبایت) | ||||
| راهنمای شیمی آلی ولهارد جلد سوم (فصل 26) : راهنمای شیمی آلی ولهارد جلد سوم (فصل 26: آمینواسیدها، پپ� ... [بیشتر] (2.42 مگابایت) | ||||
| راهنمای شیمی آلی ولهارد جلد سوم (فصل 25) : راهنمای شیمی آلی ولهارد جلد سوم (فصل 25: هترواتمها در ترک ... [بیشتر] (1.82 مگابایت) | ||||
| راهنمای شیمی آلی ولهارد جلد سوم (فصل 24) : راهنمای شیمی آلی ولهارد جلد سوم (فصل 24: کربوهیدراتها) تش ... [بیشتر] (2.22 مگابایت) | ||||
| راهنمای شیمی آلی ولهارد جلد سوم (فصل 23) : راهنمای شیمی آلی ولهارد جلد سوم (فصل 23: ترکیبهای دی کربو ... [بیشتر] (1.66 مگابایت) | ||||
| راهنمای شیمی آلی ولهارد جلد سوم (فصل 22) : راهنمای شیمی آلی ولهارد جلد سوم (فصل 22: شیمی بنزن استخ� ... [بیشتر] (2.34 مگابایت) | ||||
| راهنمای شیمی آلی ولهارد جلد سوم (فصل 21) : راهنمای شیمی آلی ولهارد جلد سوم (فصل 21: : آمینها و مشتقات ... [بیشتر] (2.67 مگابایت) | ||||
| راهنمای شیمی آلی ولهارد جلد سوم (فصل 20) : راهنمای شیمی آلی ولهارد جلد سوم (فصل 20: مشتقات کربو کسیل ... [بیشتر] (2.57 مگابایت) |
| راهنمای شیمی آلی ولهارد جلد سوم (فصل 19) : راهنمای شیمی آلی ولهارد جلد سوم (فصل 19: کربو کسیلیک اسید ... [بیشتر] (2.21 مگابایت) | ||||
| آمونیاک : 17 صحفه (126.5 کیلوبایت) | ||||
| افزایش حجم آب هنگام انجماد : 1 صحفه (16.4 کیلوبایت) | ||||
| آشنایی با علائم هشدار دهنده در آزمایشگاه شیمی : 1 صحفه (371.0 کیلوبایت) | ||||
| Flame Ionization Detector - FID : این مقاله در مورد "دتکتور های FID " هست که در دستگاه های تج ... [بیشتر] (1.12 مگابایت) | ||||
| مول : 1 صحفه (13.7 کیلوبایت) | ||||
| پلیمرها : سلام این کتاب برای افرادی که در صنایع پلیمری مشغول به ف ... [بیشتر] (3.94 مگابایت) | ||||
| Food Lipids Chemistry, Nutrition, and Biotechnolog : 5.7MB زبان اصلی 1016ص (5.70 مگابایت) | ||||
| inorganic chemistry : زبان اصلی (3.42 مگابایت) | ||||
| آمونیاک : آمونیاک محرک خسارت نوری فتوسیستم 2 در حضور باکتری Cyanobacte ... [بیشتر] (126.5 کیلوبایت) | ||||
 |
شیمی سال دوم دبیرستان : کتاب شیمی دوم دبیرستان در سال 1340 (1.40 مگابایت) | |||
| Synthetic Methods Catalysis : (1.58 مگابایت) | ||||
| بررسي روش استخراج با حلال براي تصفيه فسفريك اسيد ص : -;{@ (218.1 کیلوبایت) | ||||
| Inorganic chemistry : -;{@ (4.89 مگابایت) | ||||
| لغت نامه ي شيمي : اين لغت نامه انگليسي به انگليسي است (2.88 مگابایت) |
این مطلب در تاریخ: یک شنبه 26 آبان 1392 ساعت: 21:45 منتشر شده است
طیبه پرتوی
اندازه فایل : 6.73 مگابایت
 2) دانلود خلاصه درس شیمی آلی 1 - شیمی آلی و آزمایشگاه (در قالب PowerPoint)
2) دانلود خلاصه درس شیمی آلی 1 - شیمی آلی و آزمایشگاه (در قالب PowerPoint)
طیبه پرتوی
اندازه فایل : 7.53 مگابایت
 3) دانلود خلاصه درس شیمی آلی 1 - شیمی آلی و آزمایشگاه (در قالب PowerPoint)
3) دانلود خلاصه درس شیمی آلی 1 - شیمی آلی و آزمایشگاه (در قالب PowerPoint)
طیبه پرتوی
اندازه فایل : 5.83 مگابایت
 4) دانلود خلاصه درس شیمی آلی 1 - شیمی آلی و آزمایشگاه (در قالب PowerPoint)
4) دانلود خلاصه درس شیمی آلی 1 - شیمی آلی و آزمایشگاه (در قالب PowerPoint)
طیبه پرتوی
اندازه فایل : 6.2 مگابایت
این مطلب در تاریخ: شنبه 18 آبان 1392 ساعت: 22:8 منتشر شده است
آزمایشگاه شیمی آلی 1
آمینهای آروماتیک
روشهای تهیه آمینهای آروماتیک
روش آزمایشگاهی
روش ساده برای سنتز آمینهای آروماتیک ، احیای ترکیبات نیترو است. معمولا در آزمایشگاه از اسید کلریدریک و فلزاتی چون روی ، قلع ، یا آلومینیم و حتی ZnCl2برای احیای گروههای نیترو استفاده میشود.
روش صنعتی
در صنعت برای احیای مشتقات نیترو و تبدیل آن به آمین مربوطه از آهن قراضه استفاده میشود و مقدار کمی اسید بعنوان کاتالیزور به محیط اضافه میگردد. مزایای این روش در این است که گذشته از آمین ، اکسید آهن نیز تولید میشود. همچنین میتوان با اندکی تغییر در شرایط کار به مشتقات آریل هیدروکسید آمین ، آزو بنزن ، دیفنیل هیدرازین و N– اکسی دی آزوبنزن نیز رسید که به آن ، سنتز Haber گویند.
استفاده از کاتالیزورها
در حضور کاتالیزورهایی مثل نیکل ، پلاتین یا پالادیم نیز میتوان ترکیبات نیترودار را هیدروژندار کرد و آمین مربوطه را بدست آورد. با این روش آمینهای آروماتیک در مقیاس تجاری تهیه میشود.
واکنشهای حذف – افزایش
اگر هالیدهای آروماتیک تحت تاثیر آمیدورسدیم در آمونیاک مایع قرار داده شوند، ابتدا واکنش حذف انجام میگیرد و ترکیب فعالی به نام بنزاین تولید میشود که تحت تاثیر آمیدورسدیم قرار گرفته ، آمین مربوطه را تولید مینماید. واکنش مشابه با هالیدهای نفتالین به تشکیل دو نوع آمین منجر میشود.
واکنشهای جانشینی هستهخواهی
روش دیگر تهیه آمینهای آروماتیک ، انجام واکنشهای جانشینی هستهخواهی است. بعنوان مثال از واکنش آنیلین با نمک آنیلینیوم هیدروکسید کلراید آمینهای نوع بالاتر سنتز میشود.
تهیه نیتروزو آمین
هرگاه آمینهای آروماتیک نوع اول در حضور محلول سرد و آبکی یک اسید معدنی و نیتریت سدیم قرار گیرد، ترکیب N– نیتروزو آمین تشکیل میگردد. آمینهای آروماتیک نوع دوم نیز تحت شرایط ذکر شده بالا ترکیب N – نیتروزوی مربوطه را تولید میکنند. آمینهای آروماتیک سه استخلافدار مانند N و N– دی متیل آنیلین نیز با اسید نیترو واکنش میدهند و در نهایت پارا نیتروزو - N و N – دی متیل آنیلین تولید مینماید.
نمکهای دی آزونیوم
آمینهای آروماتیک نوع اول و محلول سرد و آبکی اسیدهای معدنی و نیتریت سدیم با هم واکنش میدهند. ابتدا ترکیب N– نیتروزو آمین تشکیل میشود که در حضور مازاد اسید معدنی به نمک دی آزونیوم تبدیل میگردد. نمکهای دی آزونیوم خیلی فعال هستند بطوریکه در دمای حوالی صفر درجه خود بخود شکسته میشوند. از اینرو لازم است که پس از تولید بلافاصله مصرف شوند.
بطور کلی نمکهای دی آزونیوم آمینهای آروماتیک در دو دسته مهم از واکنشها شرکت میکنند. دسته اول ، واکنشهای جانشینی هستند که در جریان این واکنشها نیتروژن آزاد میشود و گروه دیگری بجای آن جانشین میگردد. دسته دوم واکنشهای زوج شدن هستند که طی آن ، نمک دیآزونیوم از طریق نیتروژن به یک گروه آروماتیک یا هترو آروماتیک متصل میشود. هر دو دسته واکنش از نظر سنتزی بسیار با اهمیت هستند.
این مطلب در تاریخ: پنج شنبه 10 اسفند 1391 ساعت: 10:9 منتشر شده است
پیوندهای آروماتیک
در شيمي پيوند آروماتيک به يک پيوند آلي گفته ميشود که در آن يک حلقه جفت از پيوندهاي غيراشباع، جفتهاي تکي يا اربيتالهاي خالي يک استواري قويتر از استواري جفتسازي تنها را از خود نشان ميدهند.واژه آروماتيک به معني خوشبو است.
آروماتيکها، دسته وسيعي از ترکيبات را تشکيل ميدهند که شامل بنزن و ترکيباتي باشند که از نظر رفتار شيميايي مشابه بنزن ميباشند. برخي از اين مواد، حتي بهظاهر شباهتي به بنزن ندارند. برخلاف آلکنها و آلکينها، بنزن و ساير ترکيبات آروماتيک، تمايلي براي انجام واکنشهاي افزايش از خود نشان نميدهند، ولي در واکنشهاي جانشيني شرکت ميکنند که يکي از صفات شاخص اين دسته از مواد ميباشد.

گر گروههاي عاملي روي حلقه قرار بگيرند، بر واکنش پذيري حلقه اثر خواهند گذاشت. واکنش پذيري عوامل متصل به حلقه نيز بهوسيله بخش آروماتيک تحتتأثير قرار ميگيرد.
مولکولهايي آروماتيک هستند و خصلت آروماتيکي از خود نشان ميدهند که تعداد الکترونهاي سيستم π آنها، 2 و 4 و 6و 10و... باشد. اين ضرورت، قاعده هوکل يا 4n+2 ناميده ميشود. سپس ترکيباتي که براي آنها n=0, 1 , 2 ,… ميباشد، آروماتيک خواهند بود.
خصلت آروماتيکي و قاعده 4n+2 هوکل افزون بر بنزن و ترکيبات هم خانواده آن مثل نفتالين و آنتراسين و... ، مواد ديگري نيز وجود دارند که بهظاهر هيچ شباهتي به بنزن ندارند، ولي رفتاري مشابه بنزن دارند و بهعبارت سادهتر ، آروماتيک هستند. از ويژگيهاي اين مواد ميتوان به نکات زير اشاره نمود:
1. گرماي هيدروژن دار شدن و گرماي سوختن آنها پايين است. 2. براي انجام واکنشهاي افزايشي ، تمايل زيادي نشان نميدهند 3. در واکنشهاي جانشيني الکترونخواهي شرکت ميکنند. بررسيهاي تجربي مثل مطالعه خواص فيزيکي و انرژي هيدروژندار شدن سيستمها با تعداد الکترونهاي π مختلف به اين نتايج منجر شده است که:
2. مولکولهايي آروماتيک هستند و خصلت آروماتيکي از خود نشان مي دهند که تعداد الکترونهاي سيستم π آنها ، 2 و 4 و 6و 10و... باشد. اين ضرورت ، قاعده هوکل يا 4n+2 ناميده ميشود. سپس ترکيباتي که براي آنها n=0, 1 , 2 ,… ميباشد، آروماتيک خواهند بود.
3. مولکول بايد ساختمان مسطح داشته باشد. تمام ترکيباتي که اين دو شرط اساسي در آنها رعات شده باشد، زواياي پيوندي در آنها طبيعي ، همپوشاني اوربيتالهاي π مناسب و غير مستقر شدن الکترونها بخوبي ميسر باشد، پايداري مولکول بيشتر خواهد بود. يک مثال واکنش 3- کلرو سيکلوپروپن با SbCl5 ، ماده پايداري به فرمول C3H3SbCl6 ايجاد ميکند که در حلالهاي دياکسيد گوگرد مايع بخوبي حل نشده ، ولي در حلالهاي غيرقطبي نامحلول است. مطالعه طيفNMR اين ماده ، سه پروتون همارزش را به نمايش ميگذارد. اين نتايج ، با تشکيل کاتيون سيکلوپروپن که کوچکترين مولکول آروماتيک ميباشد، مطابقت دارد. ترکيبهاي آروماتيک ، هتروآروماتيک و انرژي رزونانس نتايج تجربي حاصل از واکنشهاي هيدروژن دار شدن هيدروکربنهاي جوش خورده دو حلقهاي و سه حلقهاي و... نشان ميدهد که هر چه تعداد الکترونهاي بيشتري در رزونانس شرکت کرده باشند، انرزژي آزاد شده بيشتر و پايداري نسبي نيز بيشتر خواهد بود.
نامگذاري مشتقات بنزن و ترکيبات آروماتيک جوش خورده برخي از مشتقات بنزن ، نام مخصوص به خود دارند، مثلاً هيدروکسي بنزن را فنل (C6H5OH) ، متوکسي بنزن را آنيزول (C6H5OCH3)، متيل بنزن را تولوئن (C6H5CH3) ، ايزوپروپيل بنزن را کيومن و آمينوبنزن را آنيلين ميگويند.
براي نامگذاري خيلي از مشتقات بنزن ، نام گروه يا استخلاف به صورت پيشوند بر کلمه بنزن افزوده ميشود. مثلاً فلوئورو بنزن ، ترسيوبوتيل بنزن ، نيتروبنزن ، سيکلوپروپيل بنزن نمونه هايي از اين نوع هستند. جهت نامگذاري مشتقات دو استخلافي بنزن. لازم است که محل استخلافها از پيشوند اورتو ، متا يا پارا استفاده شود؛ به عنوان مثال ، اورتو ديمتيل بنزن ، متا ديمتيل بنزن ، پارا ديمتيل بنزن.
در موارديکه دو استخلاف متفاوت روي حلقه بنزن قرار گرفته باشد و هيچکدام از گروهها نام ويژه اي به مولکول نداده باشند، پس از ذکر موقعيت گروهها با پيشوند اورتو و... ، نام گروهها را ذکر نموده ، در پايان ، کلمه بنزن بر آنها افزوده ميشود. اگر وجود يک گروه ، نام ويژه اي به مولکول بدهد، در آن صورت مولکول به عنوان مشتق آن ترکيب ويژه محسوب ميشود.
مشتقات بنزن با فشار بالا و نقطه جوش پايين هستند که با افزايش وزن مولکولي افزايش مي يابد. اين حلال داراي دانسيته بخار بالا هستند. بيشتر اين ترکيبات به عنوان مواد شميايي اوليه يا واسطه در ترکيبات ديگر بکار مي روند. حلالهاي الي همچنين در هزاران صنعت وشغل مثل :توليد رنگ ،رزين ومواد دارويي ،چاپ ، سريش و چسبها و ساخت لاستيک و… بکار مي رود.
ترکيبات اروماتيک معمول استفاده شده شامل تولوئن ،بنزن ،زايلن ،استيرن ،اتيل بنزن ،مونوکلروبنزن (MCB ) وتري متيل بنزن مي باشد. بيشتر حلالهاي اروماتيک تجاري نقطه جوشي دارند که خيلي کمتر از صفر درجه و بشتر از 200 درجه سانتيگراد نمي باشد.اگر نقطه جوش يک حلال خيلي بالاوفشار بخار آن خيلي کم باشد جداسازي حلال از موادي که براي حل کردن استفاده مي شود بسيار دشوار خواهد بود.بنابراين بسياري از حلالهاي الي در دماي اتاق مايع هستند.
حلالهاي الي بوسيله خصوصيت غير قطبي وحلاليت بالا در چربي توصيف مي شوند. اين حلالها به فراواني در مخلوطهايي در محيطهاي شغلي مثل ترکيبات تولوئن ، بنزن ، استيرن ،اتيل بنزن ، تري متيل بنزن و زايلن استفاده شده است. نفتالن ، اگر چه يک ترکيب اروماتيک است حلال نيست ، جامدي کريستالي ، سفيد رنگ دافع بيد و با فراريت بالا مي باشد. حلالهاي اروماتيک به اساني از تصفيه نفت خام و زغال مشتق مي شود وقتي زغال در فقدان هوا گرم مي شود به ترکيبات فراري شامل گاز زغال وقطران زغال شکسته مي شود. باقيمانده اين پروسه کک ناميده مي شود. تقطير قطران زغال منجر به توليد ترکيباتي مثل تولوئن ،بنزن ،زايلن ، فنول ها ، کروزول ، نفتالن مي شود.ترکيبات اروماتيک همچنين مي تواند توسط فرايند هاي کاتاليکي که در ان هيدروکربن هاي اليفاتيک در دماهاي بالا وفشار بالا براي دهيدروژنه کردن ترکيبات وشکل گيري ساختارهاي حلقوي هيدروکربن هاي اروماتيک بکار مي رود ايجاد مي شوند.
◄ فاکتورهاي دخيل در سميت حلالها:
تماس با حلالهاي اروماتيک ار طريق تماس با بخار يا مايع انها رخ مي دهد راههاي اصلي جذب راه تنفسي وپوستي است. سميت حلالها به ترکيب فيزيوشميايي انها ، سميت ذاتي ، متابوليت ها و داروهاي کلينيکي بستگي دارد. براي حلالهايي مثل بنزن و استيرن متابوليت ها سموم اصلي هستند.
فاکتورهاي سميت مي تواند بصورت زير خلاصه شود:
1. ماهيت سمي ترکيب اصلي
2. طبيعت سمي متابوليت ها
3. بافت ها وارگان هاي هدف
4. مداخله با ديگر داروها يا حلالها
5. اثر بيماريهاي قلبي
6. تماس (دوز ،مدت ، شدت )
7. خاصيت فيزيکو شميايي حلال (فشار بخار ، دانسيته بخار ، واکنش پذيري )
8. راههاي تماس (تنفسي ، پوستي ، GI )
این مطلب در تاریخ: پنج شنبه 10 اسفند 1391 ساعت: 10:3 منتشر شده است
کربوکسیلیک اسید
کربوکسیلیک اسیدها دستهای از ترکیبهای آلی هستند که یک یا چند گروه عاملی کربوکسیل«COOH-» در آنها یافت میشود.متانوییک اسید سادهترین و اتانوییک اسید آشناترین آن هاست. کربوکسیلیک اسیدهای سبک (حداکثر تا چهار اتمکربن)به خوبی در آب حل میشودولی با افزایش طول زنجیره کربنی از انحلال پذیری آنها در آب کم میشودبه طوری که بسیاری از آنها در عمل در آب نا محلولند. کربوکسیلیک اسیدها اسیدهای ضعیفی هستند و بر اثر حل شدن در آب تعدادی از مولکولهای آنها پروتون اسیدی خود را به مولکولهای آب میدهندو به سرعت به حالت تعادل میرسند.
این اسیدها یک، دو یا چند عاملی هستند که به اسیدهای آلی چند عاملی پلی الکترولیک میگویند.
| نام | نام دیگر | فرمول شیمیایی | pKa |
|---|---|---|---|
| فرمیک اسید | جوهر مورچه | HCO2H | ۳.۷۷ |
| اتانوییک اسید | استیک اسید-سرکه | CH3COOH | ۴.۷۶ |
| پروپانوییک اسید | - | C2H5COOH | |
| بوتانوییک اسید | بوتریک اسید | C3H7COOH | |
| دیاتانوییک اسید | اگزالیک اسید | HO2CCO2H | ۱.۲۷ |
| سوکسینیک اسید | - | ||
| آبیتیک اسید | - | ||
| بنزوییک اسید | - | C6H5CO2H |
نام گذاری به روش کهن
در این روش از نامی که از دیر باز برای آن به کارمی رفته بهره میجویند. مانند:استیک اسید.
این روش امروزه با وجود شمار فراوان ترکیبهای آلی کم کاربرد تر شده ولی هنوز در کاربردهای تجاری از همین روش بهره میگیرند.
نام گذاری به روش آیوپاک
- برای نام گذاریاسیدهای تک عاملی به ته نام آلکان پسوند «اوئیک» افزوده شده و سپس نام اسید آورده میشود. مانند: «متانوئیک اسید»
- برای نام گذاریاسیدهای دو عاملی افزون بر افزودن «اوئیک اسید» به ته نام آلکان پیشوند «دی» نیز به آغاز نام اسید افزوده میشود. مانند:«دی بوتانوئیک اسید»
روشهای فرآوری
- اکسید کردن آلدهیدها یا الکلها.
- ازن کافت آلکنها.
- تخمیر که به ویژه در فرآوریاستیک اسید به فراوانی به کار گرفته میشود.
- ...
کاربردها
- اسیدهای آلی مادهٔ بسیار برجسته و ارزشمند در بدن جانوران است.
- چربیها خود گونهای از کربوکسیلیک اسیدها هستند.
- در بسیاری از خوراکیها ترش مزه اسید آلی میباشد و همچنین سرکه، آبلیمو و آبغوره کربوکسیلیک اسید هستند.
- پروتئینها گونهای از اسید آلی هستند که آمین اسید(اسید آمینه) گفته میشوند.
- فرآوری استر که از واکنش اسید آلی با الکل به دست میآید.
- ساخت شوینده ها مانند صابون.
این مطلب در تاریخ: یک شنبه 6 اسفند 1391 ساعت: 13:9 منتشر شده است
آلکین
آلکینها هیدروکربنهایی هستند که دست کم یک پیوند سهگانه بین دو اتم کربن دارند. از آنجا که کوچکترین آلکین که نام آیوپاک آن اتین (C۲H۲) است، پیشتر به نام استیلن شناخته میشده است؛ آلکینها به نام استیلنها یا گروه اسیتیلنی نیز نامیده میشوند.
نامگذاری آلکینها
روش سنتی
- در نامگذاری معمولی، آلکینها به عنوان مشتقات استیلنی نامگذاری میشوند. معمولاً برای نامگذاری استیلنهای کوچک از این روش بهره گرفته میشود.
روش آیوپاک
روش جامع برای نامگذاری آلکینها روش آیوپاک(IUPAC) است و اصول آن، مشابه نامگذاری آلکنهاست و با رعایت نکات زیر انجام میشود:
- درازترین زنجیری را که پیوند سه گانه در آن قرار دارد، مشخص و کربنهای زنجیر اصلی را از طرفی شماره گذاری میکنیم که اولین کربن پیوند سهگانه شماره کوچکتری را داشته باشد.
- نام گروهها و شماره کربن محل آنها را معین و به ترتیب الفبای انگلیسی مرتب میکنیم.
- با ذکر شماره کربن محل پیوند سهگانه و تغییر نام آخر زنجیر از ane به yne نامگذاری به پایان میرسد.
خواص فیزیکی
خواص فیزیکی آلکینها، مشابه آلکنهای هم کربن است. آلکینها، ترکیباتی با قطبیت بیشتر هستند که در حلالهای با قطبیت کمتر مثل تتراکلرید کربن، بنزن و اترها بخوبی حل میشوند، ولی در آب نامحلولند. همانند سایر هیدروکربنها سبکتر از آب هستند. بررسی و مقایسه نقطه ذوب و نقطه جوش این مواد نشان میدهد که با افزایش تعداد کربن نقطه جوش افزایش مییابد و با شاخهدار شدن کاهش مییابد.
فرآوری
به طور کلی دو روش زیر برای فرآوری آلکینها به کار میرود:
- تبدیل یک آلکین به آلکینهای دیگر است که با تغییر و بزرگ کردن آلکینهای کوچک امکانپذیر میباشد.
- به وجودآوردن پیوند سهگانه کربن-کربن در مولکول میباشد که با انجام واکنشهای شیمیایی مناسب انجام پذیر میباشد.
این مطلب در تاریخ: یک شنبه 6 اسفند 1391 ساعت: 13:3 منتشر شده است
آلکن
آلکنها، هیدروکربنهایی هستند که یک پیوند دوگانه کربن – کربن (C=C) دارند. آلکنها سیر نشده هستند، یعنی میتوانند هیدروژن بگیرند و سیر شوند.
برای نامگذاری آنها از دستور زیر استفاده میشود:
تعداد اتمهای کربن (به عدد یونانی) + پسوند (ان)
این مطلب در تاریخ: یک شنبه 6 اسفند 1391 ساعت: 13:0 منتشر شده است
آمید
آمید را در شیمی میتوان یکی از دو نوع ترکیب شیمیایی زیر دانست:
- یک گروه عاملی یا ترکیبی آلی است که شامل یک گروه کربونیل (C=O) میباشد و با یک اتم نیتروژن(N) پیوند دارد.
- نوع ویژهای از آنیون نیتروژن.
آمیدها پایدارترین نوع از گروه عاملی کربونیل هستند.

تلفظ علمی
بسیاری از شیمیدانان انگلیسیزبان برای ایجاد دگرسانی میان این دو نوع ترکیب، از تلفظ {{|ə'mɪd}} برای اشاره به این ترکیب به عنوان یک گروه عاملی کربونیل و از تلفظ ['æmɑɪd] برای اشاره به آن به عنوان آنیون نیتروژن بهره میگیرند. این در حالی است که شماری از شیمیدانان نیز فرقی میان این دو نگذاشته و در هر دو کاربرد آن را ['æmɪd] تلفظ میکنند.
مشتقات
اگر در بنیان آمیدها جایِ کربنی که با اکسیژن پیوند دوگانه دارد گوگرد قرار دهیم گروهی به نام سولفوآمید خواهیمداشت.
آمیدهای حلقهای را لاکتوم مینامند.
این مطلب در تاریخ: یک شنبه 6 اسفند 1391 ساعت: 12:57 منتشر شده است
اتر
- برای دیگر کاربردها اتر (ابهام زدایی) را ببینید.
اتر نامی است که به ترکیبهای شیمیایی که گروه اتری دارند گفته میشود. این گروه یک اکسیژن است که از دو سو به دو گروه آلکیل پیوند دارد.
ویژگیهای فیزیکی
- نمیتوانند بین خودشان پیوند هیدروژنی داشته باشند.
- دمای جوششان نسبت به کتونها و آلدهیدها و کربوکسیلیک اسیدها پایین است.
- اترها باز لوییس هستند.
نام گذاری اترها
روش معمولی نامگذاری اترها به شکل آلکوکسی آلکان است. برای نمونه:(اتوکسیاتان، CH۳-CH۲-O-CH۲-CH۳). هر چند که روش کمکاربردتری نیز برای نامگذاری اترها هست که در آن نخست نام دو گروه آلکیلی که با اکسیژن پیوند دارند آمده و سپس نام اتر میآید. اتر نامبرده در روش دوم دیاتیل اتر نامگذاری میشود.
اترهای نوع اول، دوم و سوم
اترها بسته به گروه کربنی که به اکسیژن آنها پیوند داشته باشد در این سه گروه جای میگیرند. در اینجا از هر نوع یک نمونه آورده شدهاست. یک اتر نوع اول: دیاتیل اترCH۳-CH۲-O-CH۲-CH۳. یکاتر نوع دوم:دیایزوپروپیل اتر (CH۳)۲CH-O-CH(CH۳)۲ و یک اتر نوع سوم: دیترسیوبوتیل اتر (CH۳)۳C-O-C(CH۳)۳.
دیمتیل اتر، یک اتر نوع اول، نوع دوم، نوع سوم
چند اتر معروف
- اتیلن اکسید، کوچکترین اتر حلقوی:

- دیمتیل اتر: یک افشانهٔ آئروسل منفجره:

- دیاتیل اتر: یک حلکنندهٔ پرکاربرد با دمای جوش پایین:

- دیمتیلوکسی اتان، یک حلکننده با دمای جوش بالا:

- دیاکسان، یک اتر حلقوی که حلکنندهای با دمای جوش بالاست. :

این مطلب در تاریخ: یک شنبه 6 اسفند 1391 ساعت: 12:54 منتشر شده است
کتون
یک کتون یک گروه عاملی است که با یک گروه کربونیل که با دو اتم کربن دیگر پیوند دارد؛ شناخته میشود. یک کتون را میتوان با فرمول زیر بیان کرد.
- R۱(CO)R۲
اتم کربن که با دو اتم کربن پیوند دارد آن را از گروههای عاملی کربوکسیلیک اسیدها، آلدهیدها، استرها، آمیدها و دیگر ترکیبهای اکسیژندار جدا میکند. پیوند دوگانهٔ گروه کربونیل نیز کتونها را از الکلها و اترها باز میشناساند.
به کربنی که به کربن گروه کربونیل چسبیده کربن آلفا و به هیدروژنی که به این کربن چسبیده هیدروژن آلفا گویند. در حضور یک کاتالیزور اسیدی کتون به keto-enol tautomerism مربوط میشود. واکنش با یک پایه قوی انول متناظر را نتیجه میدهد
این مطلب در تاریخ: یک شنبه 6 اسفند 1391 ساعت: 12:50 منتشر شده است
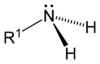
آمین
برای دیگر کاربردها، آمین (ابهامزدایی) را ببینید.
| آمین نوع یک | آمین نوع دو | آمین نوع سه |
|---|---|---|
 |
 |
 |
آمینها(به انگلیسی: Amines)) ترکیبات آلی هستند که جزو بازها به شمار رفته و یک اتم نیتروژن مرکزی و یک یا دو یا سه گروه آلکیل متصل به آن هستند که به ترتیب آمین نوع یک، آمین نوع دو و آمین نوع سه نامگذاری میشوند آمینها معمولا از آمونیاک استخراج میشوند که جای هیدروژنها گروه آلکیلی قرار میگیرند. خاصیت بازی آمین نوع دوم از بقیه بیشتر بوده و این گروه با تاثیر روی سیستم عصبی انسان کاربردهای گستردهای پیدا کردهاند و بعضی از پیکهای عصبی انسان مانند آدرنالین آمین اند و بعضی از جلوگیری کنندهها مانند مرفین نیز در گروه آمینها قرار میگیرند. از دیگر ترکیبات آمین میتوان به کدیین، افندرین، اشاره کرد. از دیگر آمینهای مهم آمینواسیدها نیز هستند.
امنیت
آمینهای کوچک سمیاند و بعضی از آنها خاصیت خورندگی پوست انسان را دارند و آمینهای بزرگ معمولا از لحاظ زیستشناسی بسیار فعالند.
این مطلب در تاریخ: یک شنبه 6 اسفند 1391 ساعت: 12:49 منتشر شده است
آلدهید
آلدهید ترکیبی آلی است که یک گروه کربونیل در یک سر خود دارد. این گروه عاملی دارای کربنی است که از یک سو با پیوند دوگانه به اکسیژن و از سوی دیگر یک اتم هیدروژن پیوند دارد. فرمول شیمیایی این بخش از ماده را (-CHO) مینویسند.
این مطلب در تاریخ: یک شنبه 6 اسفند 1391 ساعت: 12:27 منتشر شده است
گروه عاملی
گروه عاملی، در شیمی آلی، به گروههای معینی از اتمهای یک مولکول گفته میشود که در واکنشهای شیمیایی ویژه آن مولکول شرکت میکنند. گروههای عاملی یکسان در یک مولکول به واکنش شیمیایی یکسان در آن مولکول میانجامند.
برای نمونه گروه عاملی آلدهید میتواند واکنش کاهش و اکسایش بدهد.
جدول گروههای عاملی رایج
در زیر لیستی از گروههای عامل متداول است. در فرمول، نمادهای R و 'R که معمولاً به معنی هیدروژن و یا زنجیرههای هیدروکربن با هر طول ممکن است، ولی برخی اوقات ممکن است به هر گروه از اتمهای برگردد.
هیدروکربنها
گروههای عاملی که بر اساس تعداد و طرز قرار گیری پیوندهای پی تفاوت شیمیایی پیدا میکند. همهٔ موارد زیر شامل پیوندهای C-H است اما هریک تفاوتهایی در نوع واکنش پذیری دارد.
| رده شیمیایی | گروه | فرمول | فرمول ساختاری | پیشوند | پسوند | مثال |
|---|---|---|---|---|---|---|
| آلکان | آلکیل | RH | آلکیل- | -ane |  اتان |
|
| آلکن | آلکنیل | R۲C=CR۲ |  |
آلکنیل- | -ene | 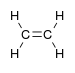 اتیلن (اتن) |
| آلکین | آلکینیل | RC≡CR' | آلکینیل- | -yne | استیلن (اتین) |
|
| مشتقات بنزن | فنیل | RC۶H۵ RPh |
فنیل- | -بنزن |  کومن (۲-فنیل پروپان) |
|
| مشتقات تولوئن | بنزیل | RCH۲C۶H۵ RBn |
بنزیل- | ۱-تولوئن | بنزیل بورومید (۱-بروموتولوئن) |
همچنین تعداد زیادی شاخهیا آلکانهای حلقوی هستندکه نامهای مخصوص دارند برای مثال ترت-بوتیل، بورنیل، سیکلوهگزیل و غیره.
این مطلب در تاریخ: شنبه 5 اسفند 1391 ساعت: 23:12 منتشر شده است
گلیسرول
گلیسرول، الکل سه عاملی است که به هر نسبتی در آب حل میشود؛ ولی در اتانول و دیگر حلالهای آلی بسیار کم محلول است. گلیسرول شیرین، شفاف، بیرنگ و بیبو است و در حضور گرما و مواد آبگیر (مانند HSO4K)، آب از دست داده به آلدئید دود کننده با بوی بد که مخاط را به شدت آزار میدهد تبدیل میشود. ایجاد آکرولئین با این مشخصات راهی برای تشخیص گلیسرول است.
گلیسرول در طبیعت بیشتر به صورت ترکیب با اسیدهای چرب است که چربی را میسازد. برای نمونه یک مولکول گلیسرول با ۱ یا ۳ اسید چرب مونوگلیسرید یا تریگلیسرید را می سازد؛ مانند روغن نباتی و ... .
این مطلب در تاریخ: جمعه 20 بهمن 1391 ساعت: 13:24 منتشر شده است
اتانول
اتانول یا الکل اتیلیک یا اتیل الکل با فرمول C۲H۵OH ترکیب شیمیائی با بوی خاص و آتشگیری است که در نوشیدنیهای الکلی وجود دارد. این الکل همان مادهای است که خاصیت مست کنندگی دارد و در نوشیدنیهای الکلی با درصدهای مختلف پیدا میشود. علاوه بر این در صنایع مختلف کاربرد فراوان دارند. این کاربردها در عطرها و ادکلنها و همچنین در وانیل و همچنین به عنوان سوخت در برخی ماشینهای جدید میباشد. برای استفاده از این الکل در صنایع عطر سازی استفاده میکنند.
مخمر آبجو ، قارچی است که با جوانهزدن تکثیر میشود، اگر این قارچ در مجاور یک ماده قندیتخمیر شود، موادی از خود خارج میکند که خاصیت آنزیمی داشته و موجب دگرگونی قند میشود. در بین قندها ، گلوکز به فرمول C۶H۱۲O۶ است که در انگور وجود دارد که پس از تخمیر باعث ایجاد الکل میشود.
این مطلب در تاریخ: جمعه 20 بهمن 1391 ساعت: 13:15 منتشر شده است
پاورپوینت های شیمی

در این پست اسلایدهای پاورپوینت مرتبط با آموزش شیمی را قرار میدهیم و قصد داریم آن را به مرور زمان به روز کنیم. ضمن این که تشکر خود را از عزیزانی که این پاورپوینتها را تهیه نموده و به اشتراگ گذاشتهاند، اعلام مینمائیم.
باز تعریف آنتروپی از دیدگاه ماکروسکوپی و مولکولی با رویکرد آموزشی (همراه با ارزیابی کتاب شیمی ۳ در رابطه با آنتروپی و قانون دوم)
تهیه کننده: دکتر غلامعباس پارسافر (دانشگاه صنعتی شریف)
۱٫۵۱MB
مدل الکترون نقطه ای و ساختار لوئیس
تهیه کننده: مجید معین السادات (با تشکر از آقای فرشاد میرزائی ولدی بخاطر معرفی)
۷۱۷KB
ماده و ساختار آن
تهیه کننده: منصور رحیمی (از شهر بم)
۱٫۴۴MB
استفاده از آنالوگ در آموزش شیمی
دبیرخانه راهبری درس شیمی- تهران
۹۹۵KB
اصل آفبا و آرایش الکترونی اتمها
تهیه کننده: عبدالکریم فاضلی (سرگروه شیمی استان کهگیلویه و بویر احمد)
۱٫۵MB
آموزش شیمی ۲: بخش اولبخش دومبخش سومبخش چهارمبخش پنجم
تهیه کننده: آقایان همایونی و توکلی (گروه شیمی استان فارس)
۱۱MB
پیوند قطبی
تهیه کننده: هاجر علیپورنیا (گروه شیمی شهرستان نقده)
۳۰۰KB
انتروپی
تهیه کننده: شایان نصرالهی (دبیر شیمی شهرستان نوشهـر)
۷۰۰KB
خواص کولیگاتیو محلولها
تهیه کننده: شایان نصرالهی (دبیر شیمی شهرستان نوشهـر)
۱٫۱MB
این مطلب در تاریخ: یک شنبه 15 بهمن 1391 ساعت: 19:3 منتشر شده است
تست های شناسایی فنول ها
فنولها ترکيبات اسيدي هستند که قدرت اسيدي آنها از کربوکسيليک اسيدها کمتر است اين امر در مورد فنولهايي که داراي استخلافهاي نيترو هستند صدق نمي کند. برخی از آزمايشهايي که در شناسايي فنولها مورد استفاده قرار مي گيرد در زیر امده است.
1- محلول سديم هيدروکسيدانحلال پذيري فنولها در محلول سيدم هيدروکسيد، در مورد فنولهايي که امکان مزدوج شدگي در باز مزدوج (آنيون فنولات) آنها زياد است، با رنگي شدن محلول همراه است. براي مشاهده رنگ، بايد مقدار کمي از فنول را در محلول سديم هيدروکسيد 10% حل نمود. انحلال بعضي فنولها با رنگي شدن همراه نيست. و تعدادي از آنها نيز در محلول سديم هيدروکسيد نامحلول هستند و بصورت رسوب مي باشند.
2- فريک کلريد فنولهاي محلول در آب
چند قطره محلول آبي فريک کلريد 5/2% به يک ميلي ليتر محلول آبي و رقيق فنول ( حدود 3-1% وزني ) اضافه نماييد. در مورد بيشتر فنولها رنگ قرمز تند، آبي، ارغواني يا سبز ظاهر مي شد. بعضي رنگها بصورت گذرا هستند و براي مشاهده رنگ بايد محلول خوب همزده شود و مخلوط گرد رنگي شدن معمولا فوري است. اما بايد توجه داشت که رنگ محلول براي زمان زيادي پايدار نيست.
فنولهاي نامحلول در آب بسياري از فنولها با روشي که پيش از اين ذکر شد و به آزمايش فريک کلريد پاسخ مثبت نمي دهند و بايد آزمايش را بدين ترتيب انجام داد که 20 ميلي گرم از فنول جامد يا يک قطره فنول مايع را در يک ميلي ليتر کلروفرم حل يا به حالت تعليق درآورد و سپس يک قطره پيريدين و سه تا پنج قطره از محلول 1 % فريک کلريد ( حجم/ وزن ) در کلروفرم به آن اضافه نماييد.
3- برم / آب
محلول آبي 1 % از مجهول تهيه نماييد سپس به آن قطره قطره محلول آب برم اشباع شده اضافه نماييد و هر بار تکان دهيد تا رنگ زايل شود. تشکيل رسوب به دليل توليد محصوص استخلاف شده است که همزمان با از بين رفتن رنگ برم است به عنوان نتيجه مثبت براي اين آزمايش تلقي مي شود.
تهيه مشتق ها
مشتقات فنولها اورتانها هستند که از واکنش فنول با ايزوسيانات توليد مي شود. مشتق هاي ديگر براي فنولها 3 و 5- دي نيترو بنزوآت و فنول برم دار شده است.
1- ( α – نفتيل اورتان )5/0 گرم از فنول ( کاملاً خشک ) را در يک لوله آزمايش خشک بريزيد و 5/0 ميلي ليتر α – نفتيل ايزوسيانات به آن اضافه نماييد.
چند قطره پيريدين به عنوان کاتاليزور به مخلوط بيافزاييد. اگر واکنش خود به خود صورت نگرفت، مخلوط را براي 10-5 دقيقه روي حمام بخار گرم نماييد. سپس لوله آزمايش را در بشر محتوي يخ قرار دهيد و براي شروع تبلور با بهمزن شيشه يي خراش دهيد. مايع روي رسوب تشکيل شده را جدا نماييد و در صورتيکه لازم است بلورها را روي بوخنر صاف نماييد. براي تخليص محلول را در 16-5 ميلي ليتر ليگروئين داغ (اتر نفت) يا هگزان حل کنيد و براي جدا کردن مواد ناخواسته و دي فنيل اوره که ممکن است موجود باشد محلول را صاف نماييد ( قبلاً قيف را گرم کنيد ). محلول صاف شده را سرد کنيد تا اورتان متبلور شود. سپس بلورها را روي قيف بوخنر صاف نماييد.
2- (3 و 5- دي نيترو بنزوآت)فنولهاي مايع
5/0 گرم 3 و 5- دي نيترو بنزوئيل کلريد را در 5/0 ميلي ليتر فنول حل نماييد و مخلوط را براي 5 دقيقه حرارت دهيد. بگذاريد محلول سرد شود و سپس 3 ميلي ليتر محلول سديم کربنات 5 % و 2 ميلي ليتر آب به آن اضافه نماييد. مخلوط را بشدت بهم بزنيد و چنانچه جامدي در مخلوط موجود است خرد نماييد. محصول را روي بوخنر صاف نماييد و با آب سرد بشوييد. براي تخليص آنرا بوسيله مخلوط حلال اتانول – آب متبلور نماييد.
فنولهاي جامد
5/0 گرم فنول را در 3 ميلي ليتر پيريدين ( خشک ) حل نماييد و 5/0 گرم 3 و 5- دي نيترو بنزوئيل کلريد به آن اضافه کنيد. مخلوط را براي 15 دقيقه رفلاکس نماييد. بگذاريد سرد شود و سپس آنرا به مخلوطي از 5 ميلي ليتر سديم کربنات 5 % و 5 ميلي ليتر آب اضافه کنيد. سپس اين مخلوط را در حمام يخ بگذاريد و بشدت بهم بزنيد تا تمام محصول واکنش بصورت بلورهايي تشکيل شود. رسوبها را با بوخنر صاف کنيد و با آب سرد بشوييد و براي تخليص آنرا با مخلوط حلال اتانول – آب متبلور نماييد.
3- بروموفنول
ابتدا چنانچه محلول برم آماده موجود نيست، بايد آنرا از انحلال 75/0 گرم پتاسيم بروميد در 5 ميلي ليتر آب و سپس 5/0 گرم برم تهيه نماييد. 1/0 گرم فنول را در يک ميلي ليتر متانول يا دي اکسان حل کنيد و سپس يک ميلي ليتر آب اضافه نماييد. حال يک ميلي ليتر مخلوط برم دار کننده را به مايع فنول بيافزاييد و مخلوط را بشدت بچرخانيد سپس افزايش محلول برم دار کننده را قطره قطره و در حاليکه مخلوط را مي چرخانيد ادامه دهيد، محلول برم دار کننده را تا وقتي که رنگ محلول برم باقي بماند بايد اضافه کرده ثابت ماندن رنگ برم در محلول، نشانه پايان واکنش برم دار کردن است. سپس بايد 5-3 ميلي ليتر آب اضافه کرد و مخلوط را بشدت تکان داد رسوبها را روي قيف بوخنر صاف نماييد و با اب بخوبي بشوييد. براي تخليص مشتق تهيه شده آنرا بوسيله مخلوط حلال متانول – آب متبلور نماييد.
این مطلب در تاریخ: یک شنبه 15 بهمن 1398 ساعت: 19:0 منتشر شده است
گزارش کار ازمایشگاه شیمی آلی
در این پست گزارش کار ازمایشگاه شیمی الی را برای شما دوستان قرار دادم تا دوستانی که با روند نوشتن گزارش کار اشنا نیستند و یا مشکلی در نوشتن گزارش کار دارند از این مطالب استفاده کنند.
قصد از ارائه این مطلب ، ارائه گزارش کار اماده نیست. امیدوارم دوستان از این مطلب کمک بگیرند نه کپی برداری !
گزارش کار ازمایشگاه شیمی آلی
دياگرام فازي سيستمهاي سه جزئي
سنتز آسپرین
سنتز استانیلید از آنیلین و استیک انیدرید
سنتز متیل سالیسیلات از سالیسیلیک اسید
کروماتوگرافی کاغذی
فریدل _کرافتس
کلایزن
دانلود کل ازمایش ها در یک فایل
پس از دانلود فایل را از حالت فشرده خارج کنید.
پسورد : www.4800.blogfa.com
این مطلب در تاریخ: یک شنبه 15 بهمن 1391 ساعت: 18:52 منتشر شده است
کتاب گزارش کار شیمی آلی
کتاب آزمایشگاه شیمی آلی که امروز برای دوستان آماده دانلود شده...
پسورد:(www.y-aspen.loxblog.com
این مطلب در تاریخ: پنج شنبه 28 دی 1391 ساعت: 1:5 منتشر شده است
دانلود کتاب الکلها در یک نگاه
-

عنوان : کتاب الکلها در یک نگاه
نویسنده : علیرضا مینائی فر
نوع : شیمی
زبان : فارسی
نوع فایل : PDF
تعداد صفحات : 20
حجم : 207 کیلوبایت
درباره کتاب :
عناوین:
طبقه بندى و ساختمان الکلها
نامگذارى الکلها طبق سیستم آیوپاک IUPAC
خواص فیزیکى الکلها
تهیه الکلها
واکنشهاى الکلها
شناسایی الکلها
آزمایشات شناسایی و طبقه بندى
مشتق سازی الکلها
 هشدار :
هشدار :
IE: در صورت دانلود نشدن کتاب، بر روی دکمه Download راست کلیک کرده و گزینه ...Save Target As را انتخاب کنید.
Firefox: در صورت دانلود نشدن کتاب، بر روی دکمه Download راست کلیک کرده و گزینه ...Save Link As را انتخاب کنید.
 لینک دانلود
لینک دانلود
 پسورد : www.iranmeet.com
پسورد : www.iranmeet.com
این مطلب در تاریخ: یک شنبه 17 دی 1391 ساعت: 13:36 منتشر شده است
آزمایشگاه شیمی آلی1
گزارش کار شیمی آلی
برای دانلود این مجموعه گزارش کار شیمی می توانید آن را در قالب pdf دانلود کنید
دانلود گزارشکار تعیین نقطه ذوب
دانلود گزارشکار تعیین نقطه جوش
دانلود گزارشکار واکنش های تراکمی
این مطلب در تاریخ: دو شنبه 11 دی 1391 ساعت: 2:38 منتشر شده است
مترجم آنلاین همه زبانها توسط گوگل
مترجم آنلاین گوگل یا google translate یک ابزار بسیار با ارزش و کاربردی است که اکثر اوقات در حال کار کردن با اینترنت نیاز به آن پیدا میکنیم. برای استفاده متن یا کلمه مورد نظر را انتخاب کرده , کپی کنید و در باکس گوگل ترانسلیت قرار دهید یا paste کنید. اگر سایت خاصی را برای ترجمه در نظر دارید آدرس آن را در باکس وارد کنید و لینک مربوطه را کلیک کنید تا صفحه سایت داده شده ترجمه شود ...
این مطلب در تاریخ: جمعه 8 دی 1398 ساعت: 15:11 منتشر شده است
پاور پوینت دروس تخصصی رشته شیمی کاربردی
این مطلب در تاریخ: پنج شنبه 7 دی 1391 ساعت: 2:42 منتشر شده است
دانلود کتابچه آموزش نرم افزار Chem office

برای دانلود آخرین ورژن نرم افزار Chem office اینجا کلیک کنید.
این مطلب در تاریخ: پنج شنبه 7 دی 1391 ساعت: 2:21 منتشر شده است
دانلود خلاصه درس شیمی آلی 2
دانلود خلاصه درس شیمی آلی 2
خلاصه شده از روی کتاب شیمی آلی 2 پیام نور

بسیار جامع، کامل،مفید مختصر در 10 صفحه ..
شما هم می توانید خلاصه های خود را برای ما ارسال کنید
تا دوستان خودتون از اون استفاده کنند.
این مطلب در تاریخ: پنج شنبه 7 دی 1391 ساعت: 2:12 منتشر شده است
روش تهیه الکل جامد
در دستور العمل زیر از هیدرواکسید سدیم (سود) استفاده می شود که سوز آور است و می تواند کار با آن تا حد زیادی خطرناک باشد. لطفا قبل از شروع آزمایش رفتار شیمیایی این ماده را مطالعه کنید و احتیاط های لازم را انجام دهید و مواظب باشید این ماده در معرض پوست و چشم شما قرار نگیرد.این ترکیب سریعا آتش می گیرد .
احتیاط ها:
همیشه وقتی با سود کار می کنید از دستکش و عینک استفاده کنید.
هیج وقت آب را داخل سود نریزید (باید سود را کم کم وارد آب کرد).
اگر شما از آب و سود استفاده می کنید هرگز از آب گرم یا داغ استفاده نکنید. به طوری که بشود تصور کرد که ۵۰ درصد یخ همراه با آب استفاده شده.
هرگز از قلع، روی یا آلومینیوم همراه با سود سوز آور استفاده نکنید.
سرکه را در دسترس داشته باشید تا اگر آن با پوست شما تماس پیدا کرد از آن استفاده کنید و پوستتان را با آن خیس کنید.
از جوش آمدن سوخت جلوگیری کنید چون که می تواند باعث بروز آتش سوزی و انفجار شود .
ترکیبات (کلیه عناصر بی آب هستند):
۶۷٫۷ قسمت متانول
۲۶ قسمت ایزو پروپانول
۵٫۵ قسمت اسید سیتریک
۰٫۸ قسمت هیدرواکسید سدیم (سود)
دستور العمل:
۱۰ درصد سود / متانول بسازید – ۱۰ گرم سود را در ۹۰ متانول حل کنید.
محلول را تا ۱۰۰ درجه فارنهایت گرم کنید .
اسید سیتریک را به ایزوپروپانول اضافه کنید و تا ۱۴۰ درجه فارنهایت گرم کنید (اسید سیتریک باید ذوب شود) .
مخلوط سود / متانول را به مخلوط اسید سیتریک / الکل اضافه کنید و مخلوط کنید .
سپس آن را داخل قالب بریزید .
روش دوم
ترکیبات:
۱۰۰ قسمت از الکل
۱۰ قسمت استیرن (گلسریل استر سیتریک اسید- یا پیه ) پودر یا نرم شده (از شمع فروشیها می توانید تهیه کنید).
۳ قسمت سود
دستور العمل:
یک حمام آب گرم درست کنید نباید آب جوش بیاد. سپس یک ظرف کوچک مثل قوری را درون آب قرار دهید نباید آب وارد قوری شود
سود را اضافه کنید و هم بزنید
الکل را داخل قوری کوچکتر ریخته و به آرامی استیرن را اضافه کنید و اجازه دهید آن ذوب شود.
حال آن را داخل یه ظرف غیر آلمینیومی بریزید و اجازه دهید سرد شود
روش سوم
جهت ساخت الکل جامد ابتدا یک لیترالکل متانول تهیه نمائید. سپس ۲۰تا۵۰ گرم پودرصابون تهیه نموده وآنرا در۲۵۰سی سی الکل بریزید سپس محلول را در روی چراغ با احتیاط گرم نمائید تا تمام پودر صابون حل شود. درصورت حل نشدن می توانید از ۱۰۰سی سی آب کمک بگیرید. پس از حل شدن صابون محلول را درباقی الکل ریخته وکل محلول را در ظرفی که می خواهید الکل جامد شود ریخته وظرف را در یخچال قرار دهید. پس از چند ساعت الکل جامد شما آماده است و می توانید در قطعات کوچک برش زده واستفاده نمائید.
این مطلب در تاریخ: پنج شنبه 23 آذر 1391 ساعت: 1:48 منتشر شده است
واکنش جانشینی هسته دوستی (نوکلئوفیلی)
واکنش جانشینی نوکلئوفیلی یکی از مهمترین واکنشهای شیمی آلی است که بسیاری از ترکیبات آلی مهم، با این روش سنتز میشوند. جانشینی نوکلئوفیلی، ابزار کار در سنتز شیمی آلی است و هرگاه که موضوع تعویض یک گروه عاملی با گروه عاملی دیگر مطرح شود، از این روش استفاده میشود. این واکنش جزو واکنشهای گسست ناجور است، یعنی در اثر شکستن یا تشکیل پیوند، جفت الکترون، روی یکی از اجزا است. این واکنش، در محلول انجام میشود و حلال نقش مهمی در انجام آن دارد و با توجه به ساختار واکنش دهندهها از طریق دو مکانیسم پیش میرود.
تعاریف اولیه
سوبسترا
ترکیبی که واکنش جانشینی روی آن انجام میشود و با ویژگی حضور گروه ترک کننده در آن شناخته میشود.
گروه ترک کننده
گروهی که از کربن جدا شده، جفت الکترون را با خود میبرد که معمولا باز ضعیفی است.
واکنشگرهای نوکلئوفیل
واکنشگرهای بازی پُر الکترون که تمایل دارند به هسته کربن حمله کنند. هنگامیکه این حمله به جانشینی میانجامد، واکنش را جانشینی هسته دوستی (نوکلئوفیل) مینامند. ترکیباتی مانند آلکیل هالیدها که دارای یک گروه ترک کننده خوب با خصلت بازی ضعیف مانند یون هالید هستند، در حضور یک هسته دوست قوی واکنشهای جانشینی نوکلئوفیلی را انجام میدهند. بعنوان مثال در واکنش
CH3:Br + :OH- --> CH3:OH + :Br-
گروه برمید ترک کننده، زوج الکترون مشترک با کربن را با خود میبرد و یون هیدروکسید، زوج الکترون مورد نیاز برای اتصال به کربن را با خود میآورد.
این مطلب در تاریخ: چهار شنبه 22 آذر 1391 ساعت: 14:39 منتشر شده است
کاربرد طیف سنجی در شیمی آلی
 دانلود کتابچه نمونه سوالات کاربرد طیف سنجی در شیمی آلی
دانلود کتابچه نمونه سوالات کاربرد طیف سنجی در شیمی آلی
اندازه فایل : 20.54 مگابایت
این مطلب در تاریخ: سه شنبه 21 آذر 1391 ساعت: 12:39 منتشر شده است
سنتز بنزوپیناکول (یک واکنش فتوشیمیایی)
واکنشهای فتوشیمیائی مربوط به مولکولهایی است که با انرژی زیادی برانگیخته میشوند و روشهای سنتزی دیگر برای آنها مشکل است. از انواع واکنشهای فتوشیمیایی میتوان دیمر شدن، فتوایزومریزه شدن، اکسایش و کاهش را نام برد.
احیاء فتوشیمیایی بنزوفنون یکی از قدیمی ترین واکنشهای شناخته شده میباشد. بدین صورت که در حضور یک حلال پروتون دهنده مثل 2-پروپانل و نور ماوراء بنفش (hν)، یک محصول دیمر نامحلول به نام بنزوپیناکول تشکیل میدهد.

روش کار
در یک لوله آزمایش خشک به ابعاد 150 * 18 میلی متری 1 گرم بنزوفنون ریخته و آنرا با حدود 8 میلی لیتر ایزوپروپانل در حرارت ملایم حل کنید. سپس یک قطره استیک اسید گلاسیال اضافه کرده و تا سر لوله را با ایزوپروپانول پر کنید. درب لوله را با یک چوب پنبه ببندید بطوریکه هوای داخل آن به طور کامل خارج شود. چوب پنبه را با یک نوار پلاستیکی به طور کامل ببندید (نباید هوا داخل لوله باشد زیرا اکسیژن هوا با رادیکالها واکنش داده و واکنش اصلی را متوقف میکند).
لوله را در یک بشر کوچک پشت پنجره آزمایشگاه در معرض نور خورشید قرار دهید. پس از یک هفته واکنش کامل شده و بلورهای زیادی تشکیل میشود. بلورهای تشکیل شده را صاف کنید و پس از خشک کردن نقطه ذوب آنرا تعیین نمایید. راندمان واکنش در شرایط مناسب حد اقل 90% است.
مکانیسم

این مطلب در تاریخ: شنبه 13 اسفند 1390 ساعت: 22:32 منتشر شده است
تهیه سیکلوهگزن
یکی از روشهای تهیه ترکیبات سیر شده آبگیری از الکلها در مجاورت یک اسید معدنی مثل اسید سولفوریک است. مکانیسم این واکنش در سه مرحله صورت میگیرد.
1- انتقال یک پروتون از اسید به الکل و تشکیل الکل پروتونه
2- جدا شدن یک مولکول آب و بوجود آمدن یون کربونیوم
3- خروج یک پروتون از یون کربونیوم و تشکیل آلکن

روش کار
50 گرم سیکلوهگزانول را در یک بالن 250 میلی لیتری دو دهانه که مجهز به یک مبرد برگشتی و یک دماسنج است ریخته و 3 میلی لیتر اسید سولفوریک غلیظ را کم کم و در حال به هم زدن به آن اضافه کنید. آنگاه چند عدد سنگ جوش ریخته و بالن را به مدت نیم ساعت رفلاکس کنید و بگذارید تا محلول خنک شود. (دقت کنید در مدت عمل رفلاکس دما نباید بیش از 90 درجه بشود.)
حال محصول را در یک قیف جدا کننده ریخته و به آن 12 میلی لیتر محلول اشباع نمک طعام و 10 میلی لیتر محلول کربنات سدیم 10 درصد اضافه میکنیم. (برای خنثی سازی اسید اضافی). محتوی قیف جدا کننده را به شدت به هم بزنید و بعد فاز آبی را دور بریزید و به فاز آلی آب مقطر افزوده خوب به هم بزنید و پس از جدا شدن دو فاز، فاز آبی را دور بریزید و فاز آلی را به یک بشر خشک منتقل کرده و به آن 2 الی 4 گرم کلرید کلسیم اضافه کنید تا آب اضافی محلول آلی را جذب کند. بعد از حدود 20 دقیقه آنرا صاف کنید.
حال محلول را تقطیر ساده کنید و جسمی که در دمای حدود 80 الی 85 جدا میشود سیکلو هگزن میباشد.
مکانیسم:

این مطلب در تاریخ: شنبه 13 اسفند 1390 ساعت: 22:30 منتشر شده است















