پیوندهای آروماتیک
در شيمي پيوند آروماتيک به يک پيوند آلي گفته ميشود که در آن يک حلقه جفت از پيوندهاي غيراشباع، جفتهاي تکي يا اربيتالهاي خالي يک استواري قويتر از استواري جفتسازي تنها را از خود نشان ميدهند.واژه آروماتيک به معني خوشبو است.
آروماتيکها، دسته وسيعي از ترکيبات را تشکيل ميدهند که شامل بنزن و ترکيباتي باشند که از نظر رفتار شيميايي مشابه بنزن ميباشند. برخي از اين مواد، حتي بهظاهر شباهتي به بنزن ندارند. برخلاف آلکنها و آلکينها، بنزن و ساير ترکيبات آروماتيک، تمايلي براي انجام واکنشهاي افزايش از خود نشان نميدهند، ولي در واکنشهاي جانشيني شرکت ميکنند که يکي از صفات شاخص اين دسته از مواد ميباشد.

گر گروههاي عاملي روي حلقه قرار بگيرند، بر واکنش پذيري حلقه اثر خواهند گذاشت. واکنش پذيري عوامل متصل به حلقه نيز بهوسيله بخش آروماتيک تحتتأثير قرار ميگيرد.
مولکولهايي آروماتيک هستند و خصلت آروماتيکي از خود نشان ميدهند که تعداد الکترونهاي سيستم π آنها، 2 و 4 و 6و 10و... باشد. اين ضرورت، قاعده هوکل يا 4n+2 ناميده ميشود. سپس ترکيباتي که براي آنها n=0, 1 , 2 ,… ميباشد، آروماتيک خواهند بود.
خصلت آروماتيکي و قاعده 4n+2 هوکل افزون بر بنزن و ترکيبات هم خانواده آن مثل نفتالين و آنتراسين و... ، مواد ديگري نيز وجود دارند که بهظاهر هيچ شباهتي به بنزن ندارند، ولي رفتاري مشابه بنزن دارند و بهعبارت سادهتر ، آروماتيک هستند. از ويژگيهاي اين مواد ميتوان به نکات زير اشاره نمود:
1. گرماي هيدروژن دار شدن و گرماي سوختن آنها پايين است. 2. براي انجام واکنشهاي افزايشي ، تمايل زيادي نشان نميدهند 3. در واکنشهاي جانشيني الکترونخواهي شرکت ميکنند. بررسيهاي تجربي مثل مطالعه خواص فيزيکي و انرژي هيدروژندار شدن سيستمها با تعداد الکترونهاي π مختلف به اين نتايج منجر شده است که:
2. مولکولهايي آروماتيک هستند و خصلت آروماتيکي از خود نشان مي دهند که تعداد الکترونهاي سيستم π آنها ، 2 و 4 و 6و 10و... باشد. اين ضرورت ، قاعده هوکل يا 4n+2 ناميده ميشود. سپس ترکيباتي که براي آنها n=0, 1 , 2 ,… ميباشد، آروماتيک خواهند بود.
3. مولکول بايد ساختمان مسطح داشته باشد. تمام ترکيباتي که اين دو شرط اساسي در آنها رعات شده باشد، زواياي پيوندي در آنها طبيعي ، همپوشاني اوربيتالهاي π مناسب و غير مستقر شدن الکترونها بخوبي ميسر باشد، پايداري مولکول بيشتر خواهد بود. يک مثال واکنش 3- کلرو سيکلوپروپن با SbCl5 ، ماده پايداري به فرمول C3H3SbCl6 ايجاد ميکند که در حلالهاي دياکسيد گوگرد مايع بخوبي حل نشده ، ولي در حلالهاي غيرقطبي نامحلول است. مطالعه طيفNMR اين ماده ، سه پروتون همارزش را به نمايش ميگذارد. اين نتايج ، با تشکيل کاتيون سيکلوپروپن که کوچکترين مولکول آروماتيک ميباشد، مطابقت دارد. ترکيبهاي آروماتيک ، هتروآروماتيک و انرژي رزونانس نتايج تجربي حاصل از واکنشهاي هيدروژن دار شدن هيدروکربنهاي جوش خورده دو حلقهاي و سه حلقهاي و... نشان ميدهد که هر چه تعداد الکترونهاي بيشتري در رزونانس شرکت کرده باشند، انرزژي آزاد شده بيشتر و پايداري نسبي نيز بيشتر خواهد بود.
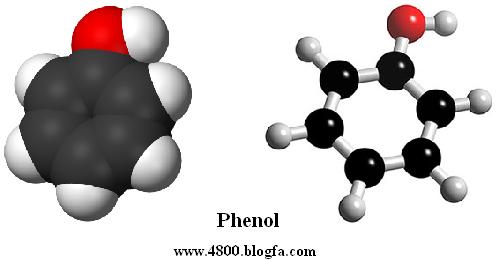
نامگذاري مشتقات بنزن و ترکيبات آروماتيک جوش خورده برخي از مشتقات بنزن ، نام مخصوص به خود دارند، مثلاً هيدروکسي بنزن را فنل (C6H5OH) ، متوکسي بنزن را آنيزول (C6H5OCH3)، متيل بنزن را تولوئن (C6H5CH3) ، ايزوپروپيل بنزن را کيومن و آمينوبنزن را آنيلين ميگويند.
براي نامگذاري خيلي از مشتقات بنزن ، نام گروه يا استخلاف به صورت پيشوند بر کلمه بنزن افزوده ميشود. مثلاً فلوئورو بنزن ، ترسيوبوتيل بنزن ، نيتروبنزن ، سيکلوپروپيل بنزن نمونه هايي از اين نوع هستند. جهت نامگذاري مشتقات دو استخلافي بنزن. لازم است که محل استخلافها از پيشوند اورتو ، متا يا پارا استفاده شود؛ به عنوان مثال ، اورتو ديمتيل بنزن ، متا ديمتيل بنزن ، پارا ديمتيل بنزن.
در موارديکه دو استخلاف متفاوت روي حلقه بنزن قرار گرفته باشد و هيچکدام از گروهها نام ويژه اي به مولکول نداده باشند، پس از ذکر موقعيت گروهها با پيشوند اورتو و... ، نام گروهها را ذکر نموده ، در پايان ، کلمه بنزن بر آنها افزوده ميشود. اگر وجود يک گروه ، نام ويژه اي به مولکول بدهد، در آن صورت مولکول به عنوان مشتق آن ترکيب ويژه محسوب ميشود.
مشتقات بنزن با فشار بالا و نقطه جوش پايين هستند که با افزايش وزن مولکولي افزايش مي يابد. اين حلال داراي دانسيته بخار بالا هستند. بيشتر اين ترکيبات به عنوان مواد شميايي اوليه يا واسطه در ترکيبات ديگر بکار مي روند. حلالهاي الي همچنين در هزاران صنعت وشغل مثل :توليد رنگ ،رزين ومواد دارويي ،چاپ ، سريش و چسبها و ساخت لاستيک و… بکار مي رود.
ترکيبات اروماتيک معمول استفاده شده شامل تولوئن ،بنزن ،زايلن ،استيرن ،اتيل بنزن ،مونوکلروبنزن (MCB ) وتري متيل بنزن مي باشد. بيشتر حلالهاي اروماتيک تجاري نقطه جوشي دارند که خيلي کمتر از صفر درجه و بشتر از 200 درجه سانتيگراد نمي باشد.اگر نقطه جوش يک حلال خيلي بالاوفشار بخار آن خيلي کم باشد جداسازي حلال از موادي که براي حل کردن استفاده مي شود بسيار دشوار خواهد بود.بنابراين بسياري از حلالهاي الي در دماي اتاق مايع هستند.
حلالهاي الي بوسيله خصوصيت غير قطبي وحلاليت بالا در چربي توصيف مي شوند. اين حلالها به فراواني در مخلوطهايي در محيطهاي شغلي مثل ترکيبات تولوئن ، بنزن ، استيرن ،اتيل بنزن ، تري متيل بنزن و زايلن استفاده شده است. نفتالن ، اگر چه يک ترکيب اروماتيک است حلال نيست ، جامدي کريستالي ، سفيد رنگ دافع بيد و با فراريت بالا مي باشد. حلالهاي اروماتيک به اساني از تصفيه نفت خام و زغال مشتق مي شود وقتي زغال در فقدان هوا گرم مي شود به ترکيبات فراري شامل گاز زغال وقطران زغال شکسته مي شود. باقيمانده اين پروسه کک ناميده مي شود. تقطير قطران زغال منجر به توليد ترکيباتي مثل تولوئن ،بنزن ،زايلن ، فنول ها ، کروزول ، نفتالن مي شود.ترکيبات اروماتيک همچنين مي تواند توسط فرايند هاي کاتاليکي که در ان هيدروکربن هاي اليفاتيک در دماهاي بالا وفشار بالا براي دهيدروژنه کردن ترکيبات وشکل گيري ساختارهاي حلقوي هيدروکربن هاي اروماتيک بکار مي رود ايجاد مي شوند.
◄ فاکتورهاي دخيل در سميت حلالها:
تماس با حلالهاي اروماتيک ار طريق تماس با بخار يا مايع انها رخ مي دهد راههاي اصلي جذب راه تنفسي وپوستي است. سميت حلالها به ترکيب فيزيوشميايي انها ، سميت ذاتي ، متابوليت ها و داروهاي کلينيکي بستگي دارد. براي حلالهايي مثل بنزن و استيرن متابوليت ها سموم اصلي هستند.
فاکتورهاي سميت مي تواند بصورت زير خلاصه شود:
1. ماهيت سمي ترکيب اصلي
2. طبيعت سمي متابوليت ها
3. بافت ها وارگان هاي هدف
4. مداخله با ديگر داروها يا حلالها
5. اثر بيماريهاي قلبي
6. تماس (دوز ،مدت ، شدت )
7. خاصيت فيزيکو شميايي حلال (فشار بخار ، دانسيته بخار ، واکنش پذيري )
8. راههاي تماس (تنفسي ، پوستي ، GI )
این مطلب در تاریخ: پنج شنبه 10 اسفند 1391 ساعت: 10:3 منتشر شده است


















 هشدار :
هشدار :
 پسورد :
پسورد : 




















