و این تیم ستارگان شیمیایی مرگ ماست. در این لیست سمومی تاریخی داریم که با رفتاری شیطانی جان میلیون ها نفر را گرفته اند و در این میان چند ماده ی شیمیایی دیگر هم هستند که در خانه ی شما هم یافت می شوند. تماس با هر یک از این خطرناک ترین مواد شیمیایی با دوز مناسب شما را شتابان به دنبال اجرای لیست کارهایی که قبل از مرگ باید انجام دهید خواهد فرستاد.
در این لیست تنها ترکیبات مرگ بار کربن، نیتروژن و اکسیژن را مرور می کنیم. هیچ پروتئینی (با عرض تاسف برای سم بوتولونیوم) و هیچ عنصر یا ایزوتوپ رادیواکتیوی (با عرض معذرت از پولونیوم-۲۱۰) در این لیست قرار نگرفته است و ترکیبات شیمیایی که ممکن است شما با آن ها در زندگی روزمره ی خود تماس داشته باشید لیست شده اند.
۱–دیجوکسین (Digoxin)

عصارهٔ گل نگشتانه. در مقادیر بسیار کم دیجوکسین باعث افزایش کارآیی قلب میشود. یک پرستار به نام چارلز کولن یا همان «فرشتهٔ مرگ» دیجوکسین دارویی را برای کشتن بیش از ۴۰ بیمار به کار برد.
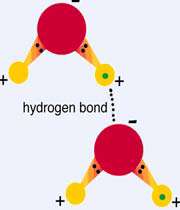
2– هیدروژن پراکسید (Hydrogen peroxide)

هیدروژن پراکسید موجود در قفسهٔ حمام شما غلظتی بین ۳ تا ۶ درصد دارد. در غلظتهای بالاتر به عنوان پیشرانهٔ موشک استفاده میشود. هیدروژن پراکسید به شدت فرار است و در غلظتهای آزمایشگاهی (بالاتر از ۷۰ درصد) با کوچکترین اشارهای منفجر خواهد شد. بمب گذاران سال ۲۰۰۵ متروی لندن از هیدروژن پراکسید به عنوان مادهٔ منفجره استفاده کرده و جان ۵۲ نفر را گرفتند.
3– اتیلن گلایکول (Ethylene glycol)

این ماده در ضد یخ ماشین شما هم هست. ارزان است و به شدت ساده به نظر میرسد. سطح سمیت میانهای دارد، با این حال مزهٔ شیرین آن میتواند سبب شود فرد در خوردن آن افراط کند و در نتیجه اتیلن گلایکول بر اثر متابولیسم به مادهٔ خطرناکتر اگزالیک اسید تبدیل شود. این ماده را از دسترس حیوانات دور نگه دارید چون ممکن است آن را با منبع غذا اشتباه بگیرند. در صورت خوردن مقدار زیادی اتیلن گلایکول مرگ به آرامی رخ میدهد و اندام بدن به صورت سیستماتیک و در عرض یک بازهٔ ۷۲ ساعته از رده خارج میشوند. راه درمان تجویز الکل خوراکی (اتیل الکل) است چون الکل با اتیلن گلایکول برای جذب شدن در بدن رقابت خواهد کرد و جلوی جذب آن را خواهد گرفت.
4– نیکوتین (Nicotine)

عضوی از گیاهان خانوادهٔ «سایهٔ شب» است و بین 0.6 تا ۳ درصد جرم سیگار را تشکیل میدهد. تماس با فرم خالص این مایع در کمتر از چند ساعت باعث مرگ میشود چون نیکوتین از طریق سلولهای غشایی پوست مستقیما وارد جریان خون میشود. سیگاریهایی که از برچسبهای نیکوتین استفاده میکنند به راحتی ممکن است دچار اوردوز و مرگ شوند.
5– سدیم سیانید (Sodium cyanide)

مادهٔ شمیایی متداولی است ولی یک قدم اشتباه باعث احساس بوی بادام خواهد شد و بعد مرگ در کمتر از چند ثانیه. سیانید به cytochrome c oxidase که پروتئینی در میتوکندری است چسبیده و سلول را از جذب اکسیژن باز می دارد.
6– استریکنین (Strychnine)

این ماده عموما به عنوان آفت کش علیه جوندگان و پرندگان استفاده میشود. به دلیل سهولت در پنهان کردن گمان میرود که استریکنین شخصیتهای تاریخی زیادی را کشته است؛ از جمله اسکندر کبیر و رابرت جانسون عضو گروه موسیقی Blues.
7– تابون (Tabun)

یکی از نخستین عاملهای اعصاب شناخته شده است. این ماده که بوی میوه شناخته میشود میتواند به شکل مه در جایی پاشیده شده و سبب تشنج و فلج شدن شود. خود تابون خیلی کشنده نیست اما موفقیت این مادهٔ شیمیایی در جنگ به پیدایش سموم خطرناک تری نظیر ریسین و سومان منجر شده است. عراق در آخرین روزهای جنگ ایران و عراق از تابون برای کشتن هزاران ایرانی استفاده کرد.
8– 2و3و7و8 تترا کلرو دی بنزو پارا دی اکسین (2,3,7,8-Tetrachlorodibenzo-p-dioxin)

چیزی در مورد عامل پرتقالی شنیدهاید؟ این ماده به عنوان آلوده کننده در عامل پرتقالی استفاده میشود که یک مادهٔ خطرناک است. عامل پرتقالی برای از بین بردن گیاهان در نواحی پر تراکم ویتنام تولید شده بود ولی منجر به نواقص پیش از تولد در نوزادان و آسیبهای پوستی شد.
9– وی ایکس (VX)

یکی از اولین سلاحهای کشتار جمعی شیمیایی است که محققین برای فروش خرده به عنوان آفت کش در دههٔ ۱۹۵۰ تولید کرده بودند. خوشبختانه احتمال تماس شما با وی ایکس بسیار پایین است چون تمام انبارهای آن در سرتاسر جهان من جمله انبار اصلی ایالات متحده در آنیستون آلاباما نابود شده اند.
10– باتراکوتوکسین (Batrachotoxin)

قویترین سم ناپپتیدی شناخته شده است. باتراکوتوکسین شهرت خود را در مصرف در دارتهای سمی که با استخراج سم از بدن قورباغه درست میشدند پیدا کرد. قورباغهها نیز این سم را مستقیما در بدن خود تولید نمیکنند بلکه از هضم پشههای مالاریایی که میخورند به دست می آورند.
می پسندم 0 نمی پسندم 0
این مطلب در تاریخ: چهار شنبه 4 بهمن 1391 ساعت: 21:4 منتشر شده است








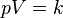
 فشار گاز ایدهآل در قبل از فرآیند
فشار گاز ایدهآل در قبل از فرآیند حجم گاز ایدهآل در قبل از فرآیند
حجم گاز ایدهآل در قبل از فرآیند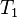 دمای گاز ایدهآل در قبل از فرآیند
دمای گاز ایدهآل در قبل از فرآیند فشار گاز ایدهآل در بعد از فرآیند
فشار گاز ایدهآل در بعد از فرآیند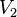 حجم گاز ایدهآل در بعد از فرآیند
حجم گاز ایدهآل در بعد از فرآیند دمای گاز ایدهآل در بعد از فرآیند
دمای گاز ایدهآل در بعد از فرآیند

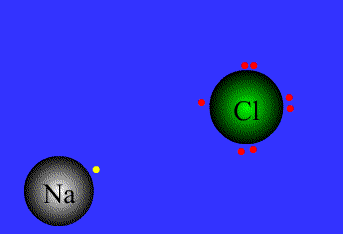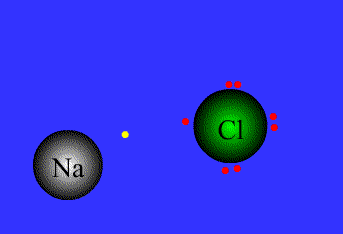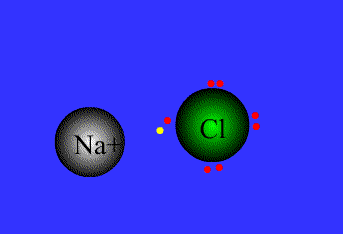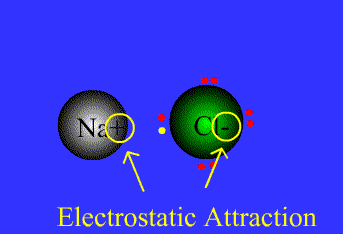


























.gif)
.jpg)
.gif)








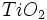 مصرفی در رنگسازی از نوع روتایل است. آناتاز را با حرارت دادن در 700-950 درجه سانتیگراد میتوان به روتایل تبدیل کرد.
مصرفی در رنگسازی از نوع روتایل است. آناتاز را با حرارت دادن در 700-950 درجه سانتیگراد میتوان به روتایل تبدیل کرد. 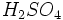 ،
، 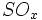 و بخار آب تولید میشود که وقتی وارد جو شوند، موجب آلودگی هوا خواهند شد. بنابراین استفاده از تصفیه کننده در کارخانهها ضروری است. از ضایعات دیگر این روش باز ، تولید اسید سولفوریک مصرف شده بدون برگشت آن به چرخه تولید میباشد.
و بخار آب تولید میشود که وقتی وارد جو شوند، موجب آلودگی هوا خواهند شد. بنابراین استفاده از تصفیه کننده در کارخانهها ضروری است. از ضایعات دیگر این روش باز ، تولید اسید سولفوریک مصرف شده بدون برگشت آن به چرخه تولید میباشد. 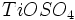
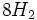
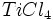 آن را تقطیر کرده و تتراکلرید تیتانیوم خالص را با اکسیژن هوا در شعلهای با دمای 1500 درجه سانتیگراد اکسید میکنند (واکنش سوختن). دراین فرایند دانههای بسیار ریز دیاکسید تیتانیوم و گاز کلر ایجاد میشود. کلر تولید شده دوباره وارد چرخه تولید میشود.
آن را تقطیر کرده و تتراکلرید تیتانیوم خالص را با اکسیژن هوا در شعلهای با دمای 1500 درجه سانتیگراد اکسید میکنند (واکنش سوختن). دراین فرایند دانههای بسیار ریز دیاکسید تیتانیوم و گاز کلر ایجاد میشود. کلر تولید شده دوباره وارد چرخه تولید میشود. 
 را ایجاد میکنند.
را ایجاد میکنند.
